题目内容
(4分)在探究金属化学性质的实验课上,小明将Zn、Fe、Cu三块打磨后的金属片同时放入稀盐酸中,观察到金属表面出现的现象是①________;②______________。于是得出金属的活动性顺序为Zn>Fe>(H)>Cu。聪明的你一定会判断出反应后溶液的质量将________(填“增加”、“不变”、“减少”)。小华将稀盐酸换成了AgNO3溶液做同样的实验,充分反应后,过滤,只得到一种固体,该固体物质是________。
(4分)
①Zn表面比Fe表面产生气泡快(或Zn表面、Fe表面都有气泡产生,Zn比Fe反应剧烈)
②Cu表面无明显现象 增加 银(或Ag)
【解析】略

氢化钙(CaH2)是一种常用的储氢材料,某化学兴趣小组通过查阅资料并在老师的指导下设计了制取氢化钙并测定制取的氢化钙样品中氢化钙的质量分数。
【资料在线】
Ⅰ.用氢气与金属钙加热的方法可制得氢化钙。
Ⅱ.氢化钙要密封保存,一旦接触到水就发生反应,放出氢气,并生成一种碱。
Ⅲ.金属钙的活动性很强,遇水即刻剧烈反应生成氢氧化钙,同时产生一种气体。
【探究一:氢化钙的制取及定性分析】
(1)写出用氢气与金属钙加热制取氢化钙的化学方程式 。
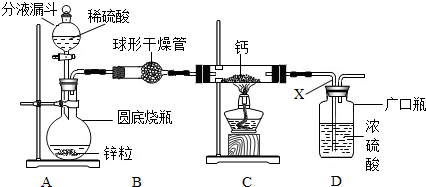
(2)下图该化学兴趣小组设计的用氢气与金属钙加热制取氢化钙的实验装置。
 |
①利用该装置进行实验,步骤如下:检查装置气密性后,装入药品,打开分液漏斗活塞,
请按正确的顺序填入下列步骤的序号 。
A.关闭分液漏斗活塞
B.点燃酒精灯,加热反应一段时间
C.收集气体并检验其纯度
D.停止加热,充分冷却
②检查整套装置气密性的方法是:连接好装置,关闭A中分液漏斗活塞,在D中放适量的水![]() 浸没 x 导管口,用酒精灯微热圆底烧瓶,若D中 x 导管口有气泡冒出,停止微热至冷却 后 x 导管中 ,说明装置不漏气。
浸没 x 导管口,用酒精灯微热圆底烧瓶,若D中 x 导管口有气泡冒出,停止微热至冷却 后 x 导管中 ,说明装置不漏气。
(3)制备氢化钙实验结束后,某同学取少量产物,小心![]() 加入水中,观察到有气泡冒出, 在溶液中滴入酚酞后显 色。
加入水中,观察到有气泡冒出, 在溶液中滴入酚酞后显 色。
该同学据此判断:上述实验确有C![]() aH2生成。你认为是否正确 (填“是”或“否”); 原因是 。
aH2生成。你认为是否正确 (填“是”或“否”); 原因是 。
【探究二:产物定量测定】
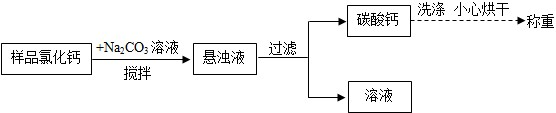
测定原理:
 |
称取上述制得的氢化钙样品(假设不含其他杂质)1.0 g加入足量的碳酸钠溶液,充分搅拌后、过滤、洗涤、干燥,称量碳酸钙质量2.4 g, 求样品中钙元素和氢元素的质量比(列 出计算过程)。
结论:该样品中氢化钙的质量分数是