题目内容
小华想测定Cu-Zn合金中铜的质量分数,小华取该合金的粉末32g,与足量硫酸充分反应后生成了0.4g气体.求出该合金中铜的质量分数.
解:设合金中锌的质量为x.
Zn+H2SO4=ZnSO4+H2↑
65 2
x 0.4g

x=13g
则合金中铜的质量为:32g-13g=19g;金中铜的质量分数=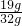 ×100%=59.4%
×100%=59.4%
答:合金中铜的质量分数为59.4%;
分析:由于铜不能与稀硫酸反应生成氢气,而锌能,根据氢气的质量,依据化学方程式,求出锌的质量,再用合金质量减去锌的质量即为铜的质量;再用合金中铜的质量除以合金的质量乘以百分之百既得合金中铜的质量分数.
点评:本题主要考查学生根据化学方程式进行简单计算的能力,解答本题关键是要对根据化学方程式进行计算的格式要规范.
Zn+H2SO4=ZnSO4+H2↑
65 2
x 0.4g

x=13g
则合金中铜的质量为:32g-13g=19g;金中铜的质量分数=
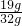 ×100%=59.4%
×100%=59.4% 答:合金中铜的质量分数为59.4%;
分析:由于铜不能与稀硫酸反应生成氢气,而锌能,根据氢气的质量,依据化学方程式,求出锌的质量,再用合金质量减去锌的质量即为铜的质量;再用合金中铜的质量除以合金的质量乘以百分之百既得合金中铜的质量分数.
点评:本题主要考查学生根据化学方程式进行简单计算的能力,解答本题关键是要对根据化学方程式进行计算的格式要规范.

练习册系列答案
相关题目
小华想测定Cu-Zn合金和Cu-Ag合金中铜的质量分数,实验室只提供了一瓶稀盐酸和相关的仪器.
(1)根据现有的条件,你认为只能测出 合金中铜的质量分数;
(2)为了测定该合金的组成,小华称取10g该合金粉末,在粉末中连续三次加入稀盐酸反应.每加一次盐酸,小华记录所得气体的质量,实验数据如下:
(3)从上表数据分析,小华用10g合金粉末总共收集到 g氢气;
(4)求出该合金中铜的质量分数.
(1)根据现有的条件,你认为只能测出
(2)为了测定该合金的组成,小华称取10g该合金粉末,在粉末中连续三次加入稀盐酸反应.每加一次盐酸,小华记录所得气体的质量,实验数据如下:
| 第一次 | 第二次 | 第三次 | |
| 连续加入盐酸的体积(ml) | 10 | 10 | 10 |
| 生成氢气的质量(g) | 0.08 | 0.08 | 0.04 |
(4)求出该合金中铜的质量分数.