题目内容
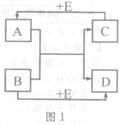
一包白色粉末由CuSO4、CaCO3、BaCl2、Na2SO4、NaOH中的三种混合而成。为探究其组成,进行以下实验:

分析实验过程,回答:
⑴白色粉末中一定有 ,一定没有 ;
⑵白色粉末三种成分的可能组合为: , 。

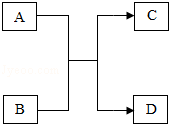
分析实验过程,回答:
⑴白色粉末中一定有 ,一定没有 ;
⑵白色粉末三种成分的可能组合为: , 。
(1)NaOH 、CaCO3;CuSO4;(2)NaOH 、CaCO3、BaCl2;NaOH 、CaCO3、Na2SO4。
根据白色粉末加水后得到无色滤液和白色沉淀,因为硫酸铜溶于水后呈蓝色,所以一定没有硫酸铜,白色沉淀可能是碳酸钙和硫酸钡中的一种或两种,白色沉淀加入足量的稀盐酸全部溶解,碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,硫酸钡不能反应不溶,所以沉淀是碳酸钙。所以固体中一定含有碳酸钙,一定没有氯化钡和硫酸铜,因为含三种固体所以还含有硫酸钠和氢氧化钠。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目