题目内容
在复合化肥硝酸钾中含有少量氯化钠.某课外活动小组拟测定此化肥中硝酸钾的含量,按下列步骤进行实验:
①称取该化肥样品10.0g;
②将样品加水溶解制成溶液;
③加入过量的硝酸银试剂,过滤;
④用蒸馏水反复洗涤沉淀多次;
⑤将沉淀小心干燥,称量,测得固体质量为2.87g;
⑥数据处理,经计算,确定化肥中硝酸钾的质量分数.
请根据上述实验步骤回答下列问题:
(1)步骤③中过滤操作所需要的仪器中除烧杯、铁架台(带铁圈)、玻璃棒外,还需要的仪器是______.
(2)步骤②和步骤③都使用到玻璃棒,但它的目的不同,在步骤②的目的是______,在步骤③的目的是______.
(3)步骤③中加入硝酸银试剂发生反应的化学方程式______.
(4)步骤③加入过量硝酸银试剂的目的是______.
(5)请计算化肥中硝酸钾的质量分数为______.
解:(1)把不溶于液体的固体与液体分离的方法是过滤;过滤用到的玻璃仪器为:玻璃棒、漏斗和滤纸、烧杯.故答案为:漏斗和滤纸
(2)玻璃棒在溶解中的作用是加快溶解速度,在过滤中的作用是引流.
(3)硝酸银与溶液中的氯化钠反应生成氯化银和硝酸钠,方程式为AgNO3+NaCl=AgCl↓+NaNO3
(3)硝酸银与氯化钠反应能生成氯化银沉淀和硝酸钠,所以滤液中含有Na+和NO3-,硝酸钾没参加反应,所以还含有K+,又因为加入的硝酸银过量,所以还含有Ag+.故答案为:Ag+、Na+、K+、NO3-
(4)步骤③加入硝酸银试剂的目的是与氯化钠反应生成沉淀,因此加入过量的目的是使氯离子完全转化成沉淀.
(5)由题意知,生成的氯化银质量为2.87g,设氯化钠的质量为X
AgNO3+NaCl=AgCl↓+NaNO3
58.5 143.5
X 2.87g
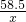 =
=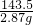
x=1.17g
硝酸钾的质量为10g-1.17g=8.83g
硝酸钾的质量分数为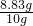 ×100%=88.3%
×100%=88.3%
故答案为:(1)漏斗和滤纸 (2)搅拌加快溶解 引流过滤液
(3)AgNO3+NaCl=AgCl↓+NaNO3 (4)为了让Cl- 沉淀完全 (5)88.3%
分析:(1)沉淀和溶液分离的方法是过滤,过滤用到的玻璃仪器为:玻璃棒、漏斗和滤纸、烧杯;
(2)根据玻璃棒在溶解、过滤中的作用解答
(3)硝酸银与溶液中的氯化钠反应生成氯化银和硝酸钠;
(4)根据溶液中生成物和没反应的物质考虑;
(5)找出已知量,利用化学方程式计算即可.
点评:本题主要考查了除杂质的问题,并根据加入的试剂对反应物的成分进行探究,以及对利用化学方程式进行计算作了考查;解答此类题目一定要认真分析,不能有一丝的马虎.
(2)玻璃棒在溶解中的作用是加快溶解速度,在过滤中的作用是引流.
(3)硝酸银与溶液中的氯化钠反应生成氯化银和硝酸钠,方程式为AgNO3+NaCl=AgCl↓+NaNO3
(3)硝酸银与氯化钠反应能生成氯化银沉淀和硝酸钠,所以滤液中含有Na+和NO3-,硝酸钾没参加反应,所以还含有K+,又因为加入的硝酸银过量,所以还含有Ag+.故答案为:Ag+、Na+、K+、NO3-
(4)步骤③加入硝酸银试剂的目的是与氯化钠反应生成沉淀,因此加入过量的目的是使氯离子完全转化成沉淀.
(5)由题意知,生成的氯化银质量为2.87g,设氯化钠的质量为X
AgNO3+NaCl=AgCl↓+NaNO3
58.5 143.5
X 2.87g
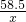 =
=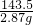
x=1.17g
硝酸钾的质量为10g-1.17g=8.83g
硝酸钾的质量分数为
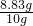 ×100%=88.3%
×100%=88.3%故答案为:(1)漏斗和滤纸 (2)搅拌加快溶解 引流过滤液
(3)AgNO3+NaCl=AgCl↓+NaNO3 (4)为了让Cl- 沉淀完全 (5)88.3%
分析:(1)沉淀和溶液分离的方法是过滤,过滤用到的玻璃仪器为:玻璃棒、漏斗和滤纸、烧杯;
(2)根据玻璃棒在溶解、过滤中的作用解答
(3)硝酸银与溶液中的氯化钠反应生成氯化银和硝酸钠;
(4)根据溶液中生成物和没反应的物质考虑;
(5)找出已知量,利用化学方程式计算即可.
点评:本题主要考查了除杂质的问题,并根据加入的试剂对反应物的成分进行探究,以及对利用化学方程式进行计算作了考查;解答此类题目一定要认真分析,不能有一丝的马虎.

练习册系列答案
相关题目
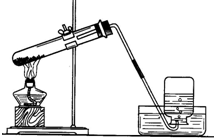 小明设计了如图所示的用加热高锰酸钾制取和收集氧气的实验装置
小明设计了如图所示的用加热高锰酸钾制取和收集氧气的实验装置 ,则下列说法正确的是
,则下列说法正确的是