题目内容
我国科学家侯德榜创造了一种著名的纯碱生产方法—“联合制碱法”。请你回答:
(1)纯碱(Na2CO3)属于 类物质(填“酸”、“碱”或“盐”)。向纯碱的水溶液中滴入酚酞试液,试液变红色,则其pH 7(填“=”、“<”或“>”)![]() 。
。
(2)“联合制碱法”生产过程用化学方程式可简要表示为:
① NH3+CO2+H2O=NH4HCO3 ② NH4HCO3+NaCl=NaHCO3↓+NH4Cl
③ 2NaHCO3 ![]() Na2CO3+H2O+CO2↑ 该过程中没有涉及到的基本反应类型是( )
Na2CO3+H2O+CO2↑ 该过程中没有涉及到的基本反应类型是( )
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
(3)第②步中加入的是磨细食盐粉。食盐磨细的目的是:
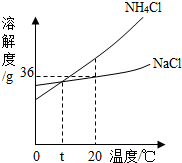
(4)从右图溶解度曲线中,你能获得的信息有:(写出2条)
(5)将第②步所得滤液(NH4Cl与剩余NaCl的混合溶液)降温,NH4Cl晶体大量析出,而NaCl却仍留在了溶液中。结合右图,你认为可能原因是:
。
所得NH4Cl属于化学肥料中的 肥,其中氮元素的质量分数为 。(精确到0.1%)

盐 > (2) ( C )
(3) 增大食盐和水的接触面积,加快食盐溶解,进而加快反应速率
(4) NH4Cl溶解度随温度升高而增大; NaCl溶解度受温度影响不大。
(5) NH4Cl溶解度受温度影响较大,而NaCl溶解度受温度影响不大 。 氮 26.2%

侯德榜创造了一种著名的纯碱生产方法--“联合制碱法”.
“联合制碱法”生产过程:
(1)第一步主要反应为NH3+CO2+H2O=NH4HCO3该反应属于基本反应类型中的
(2)第二步用食盐与NH4HCO3反应.食盐来源于某盐田,该粗盐主要含有氯化钠,此外还含有少量硫酸钠,氯化钙和氯化镁.经净化、精制得到生产碳酸钠所需要的食盐水.
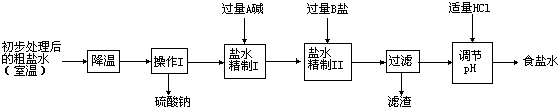
其主要流程如下:
①通过降温使硫酸钠从粗盐水中析出,说明硫酸钠的溶解度随温度的变化较
②“精制I”操作中,加入过量含钙元素的碱的化学式是
③“精制II”操作中,加入B盐的有关反应方程式为
④为保证“精制II”操作中过量B盐把杂质全部除去,写出检验溶液中B盐是否过量的实验方案:
⑤查阅资料得知NaCl、NH4HCO3、NaHCO3、NH4Cl在30℃时的溶解度如下表所示:
| 温度 | NH4Cl | NH4HCO3 | NaHCO3 | NaCl |
| 30℃ | 41.1g | 27.0g | 11.1g | 36.3g |
(3)第三步处理制得碳酸钠,反应原理为2NaHCO
| ||
(4)用“联合制碱法”制得的纯碱中常含有少量的氯化钠.为测定某纯碱样品中碳酸钠的质量分数,小雯同学称取该样品5.6g加入到盛有100g足量稀盐酸的烧杯中,完全反应后称得烧杯中的溶液质量为103.4g.求该纯碱样品中碳酸钠的质量分数.

 向纯碱的水溶液中滴入酚酞试液,试液变
向纯碱的水溶液中滴入酚酞试液,试液变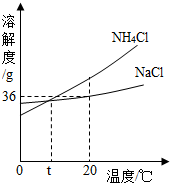 纯碱属于
纯碱属于