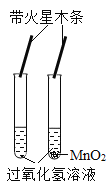
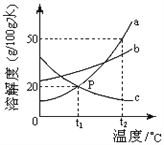
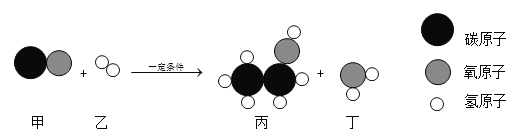
题目内容
【题目】有A、B、C、D四种可溶性化合物,分别由Ag+、Mg2+、Ba2+、Fe3+、Cl-、SO42-、NO3-、OH-八种离子中的一种阳离子和一种阴离子构成(每种离子只能选用一次)。将A、B、C、D的溶液两两混合,发生的现象为:A+B→白色沉淀;B+C→白色沉淀。根据题意请作答:

(1)写出下列物质的化学式:A____________,F中溶质___________。
(2)写出B与C反应的化学方程式:____________________________。
【答案】AgNO3 Fe(NO3)3 MgCl2+Ba(OH)2=BaCl2+Mg(OH)2↓
【解析】
根据“有A、B、C、D四种可溶性化合物,分别由Ag+、Mg2+、Ba2+、Fe3+、Cl-、SO42-、NO3-、OH-八种离子中的一种阳离子和一种阴离子构成”、“将A、B、C、D的溶液两两混合,发生的现象为:A+B→白色沉淀,B+C→白色沉淀”,结合图可知:有不溶于酸的硫酸钡或硝酸银沉淀,根据黄色溶液推测一定为含有铁离子的溶液,故推测:A为硝酸银、B为氯化镁、C为氢氧化钡、D为硫酸铁,E为硫酸钡,F为硝酸铁,代入检验,符合题意.
(1)根据分析,A为硝酸银,F为硝酸铁,则其化学式分别为:AgNO3,Fe(NO3)3;
(2)根据分析,B为氯化镁、C为氢氧化钡,则B与C反应的化学方程式为:MgCl2+Ba(OH)2═BaCl2+Mg(OH)2。

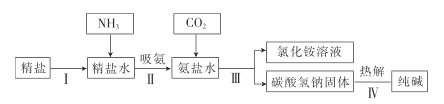
【题目】工业上常采用“双碱法”除去烟气中的![]() ,工业流程示意图如下.
,工业流程示意图如下.
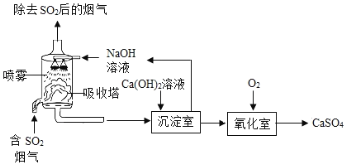
(1)吸收塔中,用NaOH溶液吸收![]() ,化学反应方程式是___.NaOH溶液喷成雾状能充分吸收SO2的原因是_____
,化学反应方程式是___.NaOH溶液喷成雾状能充分吸收SO2的原因是_____
(2)氧化室中,化学反应方程式是_______。
(3)已知部分原料的价格如表所示.
试剂 | Ca(OH)2 | NaOH |
价格(元/kg) | 0.36 | 2.90 |
上述工业流程中,处理相同量的![]() ,双碱法所需的原料成本比用NaOH直接吸收更低,原因是___
,双碱法所需的原料成本比用NaOH直接吸收更低,原因是___
(4)某中学化学兴趣小组为测定工厂周围的空气中的二氧化硫含量是否符合国家标准,将![]() 周围空气通入一定含量碘(
周围空气通入一定含量碘(![]() )2.54mg的碘水中,经测定I2与二氧化硫恰好完全反应,该反应的化学方程式是
)2.54mg的碘水中,经测定I2与二氧化硫恰好完全反应,该反应的化学方程式是![]() 。通过计算说明此烟气排放后周围空气中二氧化硫的浓度级别______。
。通过计算说明此烟气排放后周围空气中二氧化硫的浓度级别______。
[资料信息:我国空气质量标准对空气中二氧化硫的浓度级别规定如下表所示(空气中二氧化硫的浓度用单位体积的空气中所含二氧化硫的质量表示)]。
浓度级别 | 标准(mg·m-3) |
一级 | 浓度≤0.15 |
二级 | 0.15<浓度≤0.50 |
三级 | 0.50<浓度≤0.70 |