题目内容
已知某厂生产的纯碱含有少量的NaCl杂质.为测定其纯度,准确称取该纯碱样品11g,置于烧杯中,逐渐滴加某浓度的稀盐酸至不再产生气泡为止,共用去了稀盐酸93.4g.反应后的溶液经称重恰好为100g.
求:(1)该纯碱样品含碳酸钠的质量分数.
(2)反应后的溶液中NaCl的质量分数.
解:解题的关键是利用反应前后质量的变化求出二氧化碳的质量.
(1)根据质量守恒定律,反应后溶液减少的质量就是反应中生成的二氧化碳的质量,即(11+93.4)-100=4.4(g)
设参加反应的碳酸钠的质量是x
NaC03+2HCl=2NaCl+H2O+CO2↑
106 44
x 4.4g
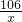 =
=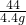
x=10.6g
∴碳酸钠的质量分数= ×100%=96.4%
×100%=96.4%
(2)设反应中生成的氯化钠质量是y,根据上面的反应方程式有
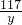 =
=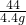
y=11.7g
∴反应后氯化钠的质量分数= ×100%=12.1%
×100%=12.1%
答::(1)该纯碱样品含碳酸钠的质量分数是96.4%.
(2)反应后的溶液中NaCl的质量分数是12.1%.
分析:通过分析题意知反应前后质量变化即为生成的二氧化碳的质量,利用二氧化碳的质量可求出碳酸钠的质量,同样也可求出生成的氯化钠的质量,再根据要求的求解内容解答即可.
点评:此题是对化学方程式计算的考查,解题的关键是找到已知量,此题则是利用反应前后物质质量的变化求出生成二氧化碳的质量,而后根据它的质量求出其它的需要的物质的质量解答即可.
(1)根据质量守恒定律,反应后溶液减少的质量就是反应中生成的二氧化碳的质量,即(11+93.4)-100=4.4(g)
设参加反应的碳酸钠的质量是x
NaC03+2HCl=2NaCl+H2O+CO2↑
106 44
x 4.4g
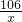 =
=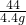
x=10.6g
∴碳酸钠的质量分数=
 ×100%=96.4%
×100%=96.4%(2)设反应中生成的氯化钠质量是y,根据上面的反应方程式有
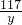 =
=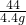
y=11.7g
∴反应后氯化钠的质量分数=
 ×100%=12.1%
×100%=12.1%答::(1)该纯碱样品含碳酸钠的质量分数是96.4%.
(2)反应后的溶液中NaCl的质量分数是12.1%.
分析:通过分析题意知反应前后质量变化即为生成的二氧化碳的质量,利用二氧化碳的质量可求出碳酸钠的质量,同样也可求出生成的氯化钠的质量,再根据要求的求解内容解答即可.
点评:此题是对化学方程式计算的考查,解题的关键是找到已知量,此题则是利用反应前后物质质量的变化求出生成二氧化碳的质量,而后根据它的质量求出其它的需要的物质的质量解答即可.

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目