题目内容
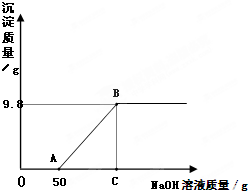 现有硫酸和硫酸铜的混合溶液200g,向该溶液中逐滴加入质量分数为10%的氢氧化钠溶液直至生成Cu(OH)2沉淀,沉淀质量与所加入的氢氧化钠溶液的质量关系如图所示.
现有硫酸和硫酸铜的混合溶液200g,向该溶液中逐滴加入质量分数为10%的氢氧化钠溶液直至生成Cu(OH)2沉淀,沉淀质量与所加入的氢氧化钠溶液的质量关系如图所示.(H2SO4+2NaOH═Na2SO4+2H2O CuSO4+2NaOH═Na2SO4+Cu(OH)2↓)
求:
(1)Cu(OH)2的相对分子质量是
98
98
.(2)生成最大沉淀量时(即B点),所加入的氢氧化钠溶液的总质量.
(3)求B点时,反应后溶质质量分数是多少?
分析:(1)根据相对分子质量等于各元素原子量之和分析解答即可;
(2)由关系图,向混合溶液中滴加氢氧化钠溶液先与硫酸反应,待混合溶液中硫酸完全反应后开始与硫酸铜溶液发生反应,因此在计算生成最大沉淀量时所加入的氢氧化钠溶液的总质量时,应该考虑到上述的反应情况,即所加入的氢氧化钠溶液的总质量为与硫酸反应的溶液和与硫酸铜反应的溶液质量和;
(3)分析题意可知,反应至B点时溶液中溶质为硫酸钠,根据氢氧化钠与硫酸酸氢氧化钠与硫酸钠反应的化学方程式,列出比例式,计算出生成硫酸钠的质量,然后根据溶质的质量分数的公式即可完成解答.
(2)由关系图,向混合溶液中滴加氢氧化钠溶液先与硫酸反应,待混合溶液中硫酸完全反应后开始与硫酸铜溶液发生反应,因此在计算生成最大沉淀量时所加入的氢氧化钠溶液的总质量时,应该考虑到上述的反应情况,即所加入的氢氧化钠溶液的总质量为与硫酸反应的溶液和与硫酸铜反应的溶液质量和;
(3)分析题意可知,反应至B点时溶液中溶质为硫酸钠,根据氢氧化钠与硫酸酸氢氧化钠与硫酸钠反应的化学方程式,列出比例式,计算出生成硫酸钠的质量,然后根据溶质的质量分数的公式即可完成解答.
解答:解:(1)Cu(OH)2的相对分子质量=64+(16+1)×2=98;
(2)设与CuSO4反应消耗的氢氧化钠质量为x,生成硫酸钠质量为y,则
CuSO4+2NaOH═Cu(OH)2↓+Na2SO4
80 98 142
x 9.8g y
=
=
x=8g,y=14.2g
氢氧化钠溶液的总质量=50g+8g÷10%=130g;
(3)设50g氢氧化钠溶液与硫酸反应生成的硫酸钠的质量为z
2NaOH+H2SO4═Na2SO4+2H2O
80 142
50g×10%g=5g z
=
解得:z=8.875g
所以C点时候,溶液中溶质的质量分数为:
×100%=7.2%;
故答案为:(1)98;(2)答:生成最大沉淀量时所加入的氢氧化钠溶液的总质量为130g.(3)答:B点时溶液中溶质的质量分数 7.2%.
(2)设与CuSO4反应消耗的氢氧化钠质量为x,生成硫酸钠质量为y,则
CuSO4+2NaOH═Cu(OH)2↓+Na2SO4
80 98 142
x 9.8g y
| 80 |
| x |
| 98 |
| 9.8g |
| 142 |
| y |
x=8g,y=14.2g
氢氧化钠溶液的总质量=50g+8g÷10%=130g;
(3)设50g氢氧化钠溶液与硫酸反应生成的硫酸钠的质量为z
2NaOH+H2SO4═Na2SO4+2H2O
80 142
50g×10%g=5g z
| 80 |
| 142 |
| 5g |
| z |
解得:z=8.875g
所以C点时候,溶液中溶质的质量分数为:
| 8.857g+14.2g |
| 130g+200g-9.8g |
故答案为:(1)98;(2)答:生成最大沉淀量时所加入的氢氧化钠溶液的总质量为130g.(3)答:B点时溶液中溶质的质量分数 7.2%.
点评:本题主要考查学生的综合分析能力.在处理图象的数据时,要注意曲线起点与折点特殊意义的分析,依据物质间反应的情况和图示数据,判断各步反应消耗氢氧化钠溶液的质量是解题的关键.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目