题目内容
实验室常用MnO2与浓盐酸反应制备Cl2,其反应方程式为:MnO2+4HCl(浓)
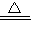 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O反应装置如图所示(夹持装置已略去).
(1)检查装置气密性之后的操作依次是 (填序号).
A.向烧瓶中加入MnO2粉末 B.加热 C.向烧瓶中加入浓盐酸
(2)制备反应会因盐酸浓度下降而停止.为测定反应残余液中盐酸的浓度,探究小组同学提出下列实验方案:
?甲同学的方案为:与足量AgNO3溶液反应,称量生成沉淀的质量.此方案 (填“可行”或“不可行”),原因是 .
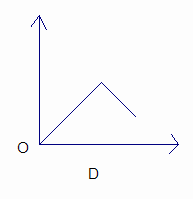
?乙同学的方案为:与足量Zn反应,测量生成的气体体积.实验装置如右图所示(夹持装置已略去).使Y形管中的残余溶液与锌粒反应的正确操作是将 转移到 中.反应完毕,每间隔1分钟读取气体体积.气体体积逐渐减小,直至不变.气体体积逐渐减小的原因是 (仪器和实验操作的影响因素除外).
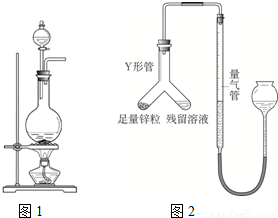
【答案】分析:(1)依据反应物及制取气体的操作步骤分析解答;
(2)甲同学的方案:二氧化锰与浓盐酸反应生成氯化锰,也会与硝酸银反应,故反应不可行;
乙同学的方案:依据锌粒与稀盐酸反应生成氢气进行分析解答;化学反应释放热量,气体体积具有热胀冷缩的特点.
解答:解:(1)检查装置气密性后,先加入固体,再加入液体:浓盐酸,然后加热;
(2)甲同学的方案:二氧化锰与浓盐酸反应生成氯化锰,也会与硝酸银反应,故不能用来测定残余液中盐酸的质量,反应不可行;
乙同学的方案:将锌转移到残留溶液中,反应完毕后,每间隔1分钟读取气体体积.气体体积逐渐减小,气体体积逐渐减小的原因是气体未冷却到室温,当温度冷却到室温后,气体体积不再改变;
故答案为:(1)ACB;
(2)①不可行; 残余液中的MnCl2也会与AgNO3反应形成沉淀;
②锌粒; 残留溶液; 气体未冷却至室温.
点评:本题考查了对实验室制取气体的实验步骤的掌握和应用,以及依据酸的性质分析、设计实验的能力.
(2)甲同学的方案:二氧化锰与浓盐酸反应生成氯化锰,也会与硝酸银反应,故反应不可行;
乙同学的方案:依据锌粒与稀盐酸反应生成氢气进行分析解答;化学反应释放热量,气体体积具有热胀冷缩的特点.
解答:解:(1)检查装置气密性后,先加入固体,再加入液体:浓盐酸,然后加热;
(2)甲同学的方案:二氧化锰与浓盐酸反应生成氯化锰,也会与硝酸银反应,故不能用来测定残余液中盐酸的质量,反应不可行;
乙同学的方案:将锌转移到残留溶液中,反应完毕后,每间隔1分钟读取气体体积.气体体积逐渐减小,气体体积逐渐减小的原因是气体未冷却到室温,当温度冷却到室温后,气体体积不再改变;
故答案为:(1)ACB;
(2)①不可行; 残余液中的MnCl2也会与AgNO3反应形成沉淀;
②锌粒; 残留溶液; 气体未冷却至室温.
点评:本题考查了对实验室制取气体的实验步骤的掌握和应用,以及依据酸的性质分析、设计实验的能力.

练习册系列答案
相关题目
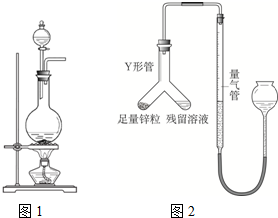 实验室常用MnO2与浓盐酸反应制备Cl2,其反应方程式为:
实验室常用MnO2与浓盐酸反应制备Cl2,其反应方程式为: