题目内容
一定量的氢氧化钠溶液中通入CO2,恰好完全反应,所得溶液的质量为53g,溶质的质量分数为20%.求原NaOH溶液的质量分数.
【答案】分析:根据题目信息可知,先算出反应后溶质(碳酸钠)的质量,然后写出化学方程式并代入碳酸钠的质量计算出氢氧化钠的质量,最后计算氢氧化钠溶液的质量分数.
解答:解:氢氧化钠和二氧化碳生成碳酸钠和水,所以反应后碳酸钠的质量=53克×20%═10.6克,设氢氧化钠的质量为X,二氧化碳的质量是Y.
2NaOH+CO2═Na2CO3+H2O
80 44 106
X Y 10.6克
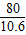 ═
═
得:X=8克
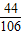 ═
═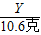
得:Y=4.4克
∴根据质量守恒定律可知,原NaOH溶液的质量=53克-4.4克=48.6克.
∴原NaOH溶液的质量分数= ×100%═16.46%.
×100%═16.46%.
答:原NaOH溶液的质量分数为16.46%.
点评:掌握化学方程式的计算格式和规范性,注意:原NaOH溶液质量的计算.
解答:解:氢氧化钠和二氧化碳生成碳酸钠和水,所以反应后碳酸钠的质量=53克×20%═10.6克,设氢氧化钠的质量为X,二氧化碳的质量是Y.
2NaOH+CO2═Na2CO3+H2O
80 44 106
X Y 10.6克
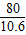 ═
═
得:X=8克
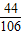 ═
═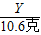
得:Y=4.4克
∴根据质量守恒定律可知,原NaOH溶液的质量=53克-4.4克=48.6克.
∴原NaOH溶液的质量分数=
 ×100%═16.46%.
×100%═16.46%.答:原NaOH溶液的质量分数为16.46%.
点评:掌握化学方程式的计算格式和规范性,注意:原NaOH溶液质量的计算.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目