题目内容
以下是某同学进行的两个实验探究
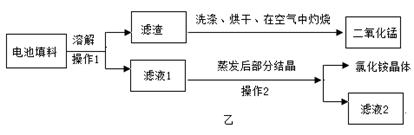
实验一:从含少量铜粉的银、锰(Mn)混合金属粉末中分离出贵金属,并获得一种盐晶体,将有关三种金属随意编号为:A、B、C,并设计了如下流程:

(1) A、B、C三种金属的活动性由强到弱的顺序为
(2)金属C是 ,操作a的名称是 。
(3)已知A的硫酸盐中A元素显+2价,请写出步骤①的反应的化学方程式: 。
实验二:研究镁条与稀盐酸反应过程中的能量变化以及反应速率的变化步骤:
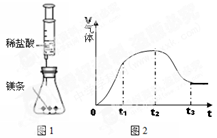
⑴ 实验前需对镁条进行打磨,目的是 .
⑵ 检查图1装置的气密性。
⑶ 将镁条放入锥形瓶中,将注射器中的稀盐酸全部压入锥形瓶中,使之反应,发生反应的化学方程式为 。
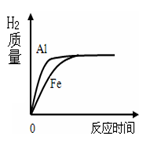
⑷ 观察注射器活塞运动变化情况,绘制出注射器内收集到的气体体积变化与时间关系的图像如图2所示。则t1~t2时间内反应速率逐渐减慢的主要原因是 .
t2~t3时间内注射器内气体体积逐渐减少的原因 。
实验一:从含少量铜粉的银、锰(Mn)混合金属粉末中分离出贵金属,并获得一种盐晶体,将有关三种金属随意编号为:A、B、C,并设计了如下流程:

(1) A、B、C三种金属的活动性由强到弱的顺序为
(2)金属C是 ,操作a的名称是 。
(3)已知A的硫酸盐中A元素显+2价,请写出步骤①的反应的化学方程式: 。
实验二:研究镁条与稀盐酸反应过程中的能量变化以及反应速率的变化步骤:

⑴ 实验前需对镁条进行打磨,目的是 .
⑵ 检查图1装置的气密性。
⑶ 将镁条放入锥形瓶中,将注射器中的稀盐酸全部压入锥形瓶中,使之反应,发生反应的化学方程式为 。
⑷ 观察注射器活塞运动变化情况,绘制出注射器内收集到的气体体积变化与时间关系的图像如图2所示。则t1~t2时间内反应速率逐渐减慢的主要原因是 .
t2~t3时间内注射器内气体体积逐渐减少的原因 。
.实验一:(1) A>B>C ;(2) 银(Ag);结晶;(3) Mn+H2SO4 = MnSO4+H2↑;实验二 (1)去除镁条表面的氧化物薄膜;Mg+ 2HCl= MgCl2 + H2↑;稀盐酸的浓度逐渐减小,反应速率减慢 ;反应停止后温度降低,气体的体积减小。
试题分析:实验一:由题中的转化图可以知道(1) A、B、C三种金属的活动性由强到弱的顺序为A>B>C ;因为回收贵重金属,故金属C为银;操作a溶液中得到溶质,所以名称是结晶;(3)已知A的硫酸盐中A元素显+2价,步骤①的反应的化学方程式Mn+H2SO4 = MnSO4+H2↑;实验二:(1)实验前需对镁条进行打磨,目的是去除镁条表面的氧化物薄膜;⑶ 将镁条放入锥形瓶中,将注射器中的稀盐酸全部压入锥形瓶中,使之反应,发生反应的化学方程式为Mg+ 2HCl= MgCl2 + H2↑;(4)t1~t2时间内反应速率逐渐减慢的主要原因是稀盐酸的浓度逐渐减小,反应速率减慢;t2~t3时间内注射器内气体体积逐渐减少的原因反应停止后温度降低,气体的体积减小。

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
相关题目