题目内容
某小组在探究铁、铜、镁、银的金属活动性顺序时,做了如下三个实验(所用金属的形状与大小和稀盐酸的用量均相同):
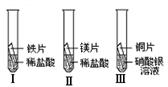
①通过实验Ⅰ和Ⅱ可比较出镁和铁的金属活动性强弱。你认为他们依据的实验现象是 。写出实验Ⅰ中反应的化学方程式: 。
②通过观察到实验Ⅲ的现象可得出的结论是 。
③上述三个实验不能够得出四种金属的活动性顺序。探究小组在上述实验的基础上,补充了一个实验(如图所示),实现了探究目的。他们的实验:金属X、Y溶液分别是 。
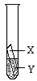

①通过实验Ⅰ和Ⅱ可比较出镁和铁的金属活动性强弱。你认为他们依据的实验现象是 。写出实验Ⅰ中反应的化学方程式: 。
②通过观察到实验Ⅲ的现象可得出的结论是 。
③上述三个实验不能够得出四种金属的活动性顺序。探究小组在上述实验的基础上,补充了一个实验(如图所示),实现了探究目的。他们的实验:金属X、Y溶液分别是 。
①实验Ⅱ比实验Ⅰ反应剧烈 Fe+2HCl →FeCl2+H2↑
②铜比银活泼
③Fe CuSO4(或Cu H2SO4)
②铜比银活泼
③Fe CuSO4(或Cu H2SO4)
试题分析:①比较金属的活动性顺序,可利用以下2个原理:1、金属与酸反应,根据是否会反应或反应的激烈程度,2、金属也盐溶液反应,看是否会反应;所以通过实验Ⅰ和Ⅱ可比较出镁和铁的金属活动性强弱。他们依据的实验现象是:实验Ⅱ比实验Ⅰ反应剧烈,实验Ⅰ中反应的化学方程式:Fe+2HCl →FeCl2+H2↑
②把铜加入到硝酸银溶液中,现象是铜表面析出一层银白色的物质,溶液由无色变为蓝色,得出的结论是:铜比银活泼
③通过实验Ⅰ和Ⅱ,可得出镁的金属活动性>铁,根据实验Ⅲ,可得出铜的金属活动性>银,所以要得出四种金属的活动性顺序,只需比较铁和铜的活动性即可,故金属X、Y溶液分别是:Fe CuSO4(或Cu H2SO4)

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目