题目内容
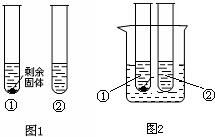 下表列出了两种固体物质的溶解度,回答下列问题:
下表列出了两种固体物质的溶解度,回答下列问题:
| 温度 溶解度 | 0°C | 10 oC | 20 oC | 30 oC | 40 oC |
| A | 37.4g | 36.0g | 34.7 g | 33.8 g | 33.2 g |
| B | 13.3 g | 20.9 g | 31.6 g | 45.8 g | 63.9 g |
(2)将硝酸钾的不饱和溶液变为饱和溶液的方法有______.
(3)10°C时,取A、B两种固体各35g,分别放入100g水中充分溶解,有如图所示的实验现象,试管①中溶解的物质是______(填“A”或“B”),其溶液中溶质的质量分数为______(保留一位小数),将两只试管分别放入盛有水的烧杯中(图2),向烧杯中加入足量NaOH并轻轻搅拌,观察到______.
(4)若向烧杯中加入适量下列物质,两试管中的现象与加NaOH不同的是______.
A.冰 B.干冰 C.生石灰 D.硝酸铵.
故答案为:水;
(2)分析表格数据,硝酸钾的溶解度随温度的升高而升高,所以将硝酸钾不饱和溶液变为饱和溶液可以通过降低温度的方法,另外将不饱和溶液变为饱和溶液还可以通过增加溶质质量或降低溶剂质量的方法.
故答案为:降低温度、加入硝酸钾、蒸发水(溶剂)
(3)分析表格数据,10℃时A的溶解度是36.0g,B的溶解度是20.9g,因为10℃时A、B各拿了35g,分别放入100g水中,所以B根本不会溶解完全,所以①中的溶剂是B,此时溶质质量分数=
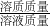 =
= =17.3%
=17.3%因为NaOH固体溶于水要放热,所以图2中试管中溶液的温度要升高,因为①中溶质是B,②中溶质是A,B的溶解度随温度的升高而升高,A的溶解度随温度的升高而降低,所以试管①中固体逐渐减少以至消失,试管②中有固体析出,
故答案为:B;17.3%; 氢氧化钠逐渐减少,烧杯变热,试管①中固体逐渐减少以至消失,②中有固体析出.
(4)因为NaOH固体溶于水要放热,所以会观察到试管①中固体逐渐减少以至消失,试管②中有固体析出,所以要想加入一种物质使观察到的现象与加NaOH时观察到的现象不同,只要这种物质溶于水吸热就可以.
故选:ABD
分析:(1)根据溶质溶剂概念作答.
(2)把溶液由饱和变为不饱和或有不饱和变为饱和,可以通过三个方法,即改变温度、改变溶剂的量、改变溶质的量.
(3)根据溶解度的概念、溶质质量分数计算、物质溶于水时的吸放热情况.
(4)根据物质溶于水时的吸放热情况即可作答.
点评:大多数固体物质的溶解度随温度的升高而增大,但也有少数固体物质的溶解度随温度的升高而降低,如氢氧化钙.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案下表列出了两种固体物质的溶解度,回答下列问题:
|


|
0oC |
10 oC |
20 oC |
30 oC |
40 oC |
||||||||||||||
|
A |
37.4g |
36.0g |
34.7 g |
33.8 g |
33.2 g |
||||||||||||||
|
B |
13.3 g |
20.9 g |
31.6 g |
45.8 g |
63.9 g |
(1)10℃时,取A、B两种固体各3.5g,分别放入10g水中充分溶解,有如图1所示的实验现象,

试管①中溶解的物质是 (填“A”或“B”),其溶液中溶质的质量分数为 (精确到0.1%)。将两只试管同时放入盛有水的烧杯中(如图2),
向烧杯中加入足量NaOH固体并轻轻搅拌,观察到两个试管中的现象分别是:
试管① ;
试管② 。
(2)若向烧杯中加入适量下列物质,两试管中的现象与加NaOH固体相同是 。
A.冰 B.氯化钠 C.生石灰 D.硝酸铵
下表列出了两种固体物质的溶解度,回答下列问题:
|
| 0oC | 10 oC | 20 oC | 30 oC | 40 oC | ||||||||||||||
| A | 37.4g | 36.0g | 34.7 g | 33.8 g | 33.2 g | ||||||||||||||
| B | 13.3 g | 20.9 g | 31.6 g | 45.8 g | 63.9 g |
(1)B为硝酸钾,硝酸钾溶液中的溶剂是 。
(2)将硝酸钾的不饱和溶液变为饱和溶液的方法有 。
(3)10 oC时,取A、B两种固体各35g,分别放入100g水中充分溶解,有如图所示的实验现象,
试管①中溶解的物质是 (填“A”或“B”),其溶液中溶质的质量分数为 (保留一位小数),将两只试管分别放入盛有水的烧杯中(图2),向烧杯中加入足量NaOH并轻轻搅拌,观察到
。
(4)若向烧杯中加入适量下列物质,两试管中的现象与加NaOH不同的是
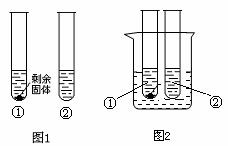 A.冰 B.干冰 C.生石灰 D.硝酸铵
A.冰 B.干冰 C.生石灰 D.硝酸铵
下表列出了两种固体物质的溶解度,回答下列问题:
|

| 0oC | 10 | 20 oC | 30 oC | 40 oC | ||||||||||||||
| A | 37.4g | 36.0g | 34.7 g | 33.8 g | 33.2 g | ||||||||||||||
| B | 13.3 g | 20.9 g | 31.6 g | 45.8 g | 63.9 g |
(1)10℃时,取A、B两种固体各3.5g,分别放入10g水
中充分溶解,有如图1所示的实验现象,试管①中溶解的
物质是 (填“A”或“B”),其溶液中溶质的质
量分数为 (精确到0.1%)。将两只试管同时放入盛有水的烧杯中(如图2),
向烧杯中加入足量NaOH固体并轻轻搅拌,观察到两个试管中的现象分别是:
试管① ![]()
![]() ;
;
试管② 。
(2)若向烧杯中加入适量下列物质,两试管中的现象与加NaOH固体相同是 。
A.冰 B.氯化钠 C.生石灰 ![]()
![]() D.硝酸铵
D.硝酸铵
