题目内容
 配制100克溶质的质量分数为10%的食盐溶液.
配制100克溶质的质量分数为10%的食盐溶液.实验步骤:
(1)计算.溶质食盐需要
10
10
克,溶剂水需要90
90
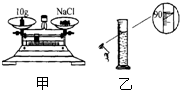
毫升.(2)称量和量取.如图是配制时部分操作步骤,请你对这些操作作出你的评价.正确的写正确,错误的写错误的原因.甲:
食盐和砝码放反了
食盐和砝码放反了
.乙:量筒读数时俯视读数了
量筒读数时俯视读数了
.(3)溶解.在此过程中玻璃棒的作用是
加速食盐溶解
加速食盐溶解
.分析:(1)根据溶质的质量分数=
×100%,溶剂质量=溶液质量-溶质质量,结合题意进行分析解答即可.
(2)配制过程为计算-称量-溶解;根据配制过程中的正确做法与要求,判断所列配制过程中的正误.
(3)根据溶解时玻璃棒的搅拌是为了加速溶解解答.
| 溶质质量 |
| 溶液质量 |
(2)配制过程为计算-称量-溶解;根据配制过程中的正确做法与要求,判断所列配制过程中的正误.
(3)根据溶解时玻璃棒的搅拌是为了加速溶解解答.
解答:解:(1)需要食盐的质量为100g×10%=10g,所需水的质量为100g-10g=90g即90毫升;
(2)称量时要左物右码,从图中看氯化钠放在右盘,砝码放在右盘;量筒的读数视线要平视凹液面的最底部不能俯视或仰视;
(3)玻璃棒搅拌能加快食盐的溶解速度.
故答案:(1)10,90;(2)
(2)称量时要左物右码,从图中看氯化钠放在右盘,砝码放在右盘;量筒的读数视线要平视凹液面的最底部不能俯视或仰视;
(3)玻璃棒搅拌能加快食盐的溶解速度.
故答案:(1)10,90;(2)
点评:本题难度不大,掌握溶质质量分数的有关计算并能灵活运用是正确解答本题的关键.

练习册系列答案
相关题目
实验室一瓶新购进的浓盐酸,其标签的部分内容如下图所示,该浓盐酸的溶质是 ,溶质的质量分数为 ;配制100.0g溶质的质量分数为14.8%的稀盐酸,需要这种浓盐酸的质量为 g.
| 化学纯 盐酸 含HCl37% 密度1.18g/cm3 容量500mL
下表是硫酸的密度和硫酸溶液中溶质的质量分数对照表(20℃)。欲配制100克溶质的质量分数为20%的稀硫酸,需要溶质的质量分数为98%的浓硫酸多少毫升?水多少毫升?(计算结果保留一位小数)
|