题目内容
 某学习小组同学用久置的过氧化氢溶液(如图)制取氧气,取2g二氧化锰于锥形瓶中,然后慢慢滴入34g过氧化氢溶液,充分反应.完成下列分析及计算:
某学习小组同学用久置的过氧化氢溶液(如图)制取氧气,取2g二氧化锰于锥形瓶中,然后慢慢滴入34g过氧化氢溶液,充分反应.完成下列分析及计算:(1)小明根据过氧化氢中氧元素的质量分数计算氧气的质量,其计算式为:
生成氧气的质量=34g×10%×
| 氧的相对原子质量×2 |
| 过氧化氢的相对分子质量 |
| 16×2 |
| 1×2+16×2 |
老师指出小明的计算是错误的,你认为错误的原因是
A.过氧化氢的氧元素的质量分数计算有误
B.过氧化氢中的氧元素没有全部转移到氧气中
(2)请你根据化学方程式帮助小明计算理论上可制取氧气的质量.
(3)小亮思考:过氧化氢不稳定会自然分解,导致溶液中溶质的质量分数减小.实验结束后,称得锥形瓶内剩余物质的总质量是35.2g.请计算这瓶过氧化氢溶液中实际溶质的质量分数.
分析:(1)根据过氧化氢生成氧气的生成物和 反应原理进行分析;
(2)根据过氧化氢分解方程式中的等量关系进行分析解答;
(3)根据氧气的量计算出过氧化氢的质量,计算质量分数;
(2)根据过氧化氢分解方程式中的等量关系进行分析解答;
(3)根据氧气的量计算出过氧化氢的质量,计算质量分数;
解答:解:(1)过氧化氢分解制取氧气时,生成了水和氧气,过氧化氢中的氧元素没有全部转化为氧气,有一部分在水中,故答案为:B;
(2)解:设生成氧气质量为x,
2H2O2
2H2O+O2↑
68 32
34×10% x
=
x=1.6g,
答:理论上可制取氧气的质量为:1.6g;
(3)根据质量守恒定律可知,生成氧气质量为:O2=34g+2g-35.2g=0.8g
设需要过氧化氢为y,
2H2O2
2H2O+O2↑
68 32
y 0.8g
=
y=1.7g,
所以 H2O2%=
×100%=5%,
答:过氧化氢溶液中实际溶质的质量分数为5%.
(2)解:设生成氧气质量为x,
2H2O2
| ||
68 32
34×10% x
| 68 |
| 3.4 |
| 32 |
| x |
x=1.6g,
答:理论上可制取氧气的质量为:1.6g;
(3)根据质量守恒定律可知,生成氧气质量为:O2=34g+2g-35.2g=0.8g
设需要过氧化氢为y,
2H2O2
| ||
68 32
y 0.8g
| 68 |
| y |
| 32 |
| 0.8 |
y=1.7g,
所以 H2O2%=
| 1.7 |
| 34 |
答:过氧化氢溶液中实际溶质的质量分数为5%.
点评:在解此类题时,首先分析考查的问题,然后结合题中的数据和方程式中的等量关系进行解答.

练习册系列答案
相关题目

 ×100%=3.2g。
×100%=3.2g。
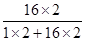 ×100%=3.2g。
×100%=3.2g。 ×100%=34g×10%×
×100%=34g×10%× ×100%=3.2g.
×100%=3.2g.

 ×100%
×100%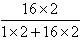 ×100%=3.2g。
×100%=3.2g。