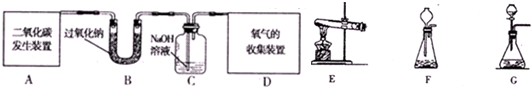
题目内容
过氧化钠
(Na2O2)是一种淡黄色固体,它能与二氧化碳反应生成氧气,也能与水反应生成氧气,反应化学方程式分别为:2Na2O2+2CO2=2Na2CO3+O2↑
2Na2O2+2H2O=4NaOH+O2↑
某学校科技活动小组的同学用大理石和稀盐酸反应制取二氧化碳并验证二氧化碳能与过氧化钠反应产生氧气这一事实,采用如图所示的仪器装置进行实验.试回答下列问题.
(1)制取二氧化碳气体的发生装置,应从图中的图1、图2、图3中选择
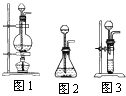
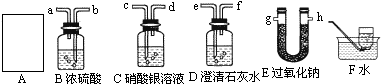
(2)同学们设计了甲、乙两种实验方案,其仪器装置连接顺序如下:甲方案:A→C→D→B→F,乙方案:A→C→B→E→D→F
你认为哪种实验方案更合理?
________(填甲或已).理由是________.(3)B装置的作用是________,气体通过该装置时应由________端进入;C装置可能出现的现象是________,检验集气瓶中收集气体的方法是________.
答案:
解析:
解析:
|
(1)图2 (2)乙,①能除去制气中可能挥发出的HCl气体;②先干燥CO2气体,避免水与过氧化钠反应对实验产生的干扰,以吸收未参加反应的二氧化碳气体 (3)吸收CO2,气体中的水蒸气,b,产生白色沉淀用带火星的木条伸入到集气瓶内,木条复燃 |

练习册系列答案
相关题目