题目内容
22、现有Na2CO3、H2SO4、Ba(OH)2三种溶液,它们所含溶质的物质的量相等,若以不同顺序将它们逐个混合起来(若出现沉淀则过滤,再将滤液与第三种溶液混合起来),最终所得的溶液…( )
分析:根据溶液中所含溶质的物质的量相等,将它们以不同顺序将它们逐个混合起来,根据最后溶液中的溶质来判断溶液的酸碱性.
解答:解:①若先发生Na2CO3、H2SO4的反应,则
Na2CO3+H2SO4═Na2SO4+CO2↑+H2O,
再发生二氧化碳与Ba(OH)2三种溶液反应,
则CO2+Ba(OH)2═BaCO3↓+H2O,
即反应后溶液的溶质为硫酸钠,溶液为中性;
②若先发生Na2CO3、Ba(OH)2溶液的反应,则
Na2CO3+Ba(OH)2═BaCO3↓+2NaOH,
再发生氢氧化钠与硫酸的反应,则
2NaOH+H2SO4═Na2SO4+2H2O,
即反应后溶液的溶质为硫酸钠,溶液为中性;
③若先发生H2SO4、Ba(OH)2溶液的反应,则
H2SO4+Ba(OH)2═BaSO4↓+2H2O,
则硫酸钡不与碳酸钠反应,即反应后的溶液为碳酸钠溶液,
溶液显碱性;
综上所述,根据题意要求溶液可能为中性,也可能为碱性,故选C.
Na2CO3+H2SO4═Na2SO4+CO2↑+H2O,
再发生二氧化碳与Ba(OH)2三种溶液反应,
则CO2+Ba(OH)2═BaCO3↓+H2O,
即反应后溶液的溶质为硫酸钠,溶液为中性;
②若先发生Na2CO3、Ba(OH)2溶液的反应,则
Na2CO3+Ba(OH)2═BaCO3↓+2NaOH,
再发生氢氧化钠与硫酸的反应,则
2NaOH+H2SO4═Na2SO4+2H2O,
即反应后溶液的溶质为硫酸钠,溶液为中性;
③若先发生H2SO4、Ba(OH)2溶液的反应,则
H2SO4+Ba(OH)2═BaSO4↓+2H2O,
则硫酸钡不与碳酸钠反应,即反应后的溶液为碳酸钠溶液,
溶液显碱性;
综上所述,根据题意要求溶液可能为中性,也可能为碱性,故选C.
点评:本题较难,学生应考虑到不同顺序反应生成的物质能否再发生化学反应,判断最终溶液中的溶质来判断溶液的酸碱性.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
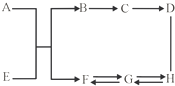 现有A~H共八种初中化学常见的物质.它们有如图所示的关系.已知A为红色固体粉末,E、F为气体,G、H溶液的PH均大于7,C、D均含三种元素且C溶液显浅绿色.
现有A~H共八种初中化学常见的物质.它们有如图所示的关系.已知A为红色固体粉末,E、F为气体,G、H溶液的PH均大于7,C、D均含三种元素且C溶液显浅绿色.