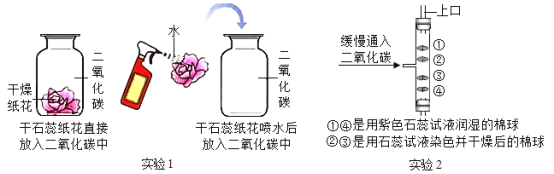
题目内容
【题目】某种手机电路板中含有Fe、Cu、Au、Ag、Ni(镍,银白色金属)等金属,如图是某工厂回收部分金属的流程图。已知:2Cu+O2+2H2SO4![]() 2CuSO4+2H2O
2CuSO4+2H2O
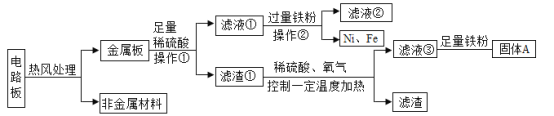
(1)写出滤液②中金属阳离子符号_____。
(2)写出滤液③和铁粉发生反应的一个化学方程式_____。
(3)Fe、Cu、Ag、Ni在溶液中的活动性由强到弱的顺序依次是_____。
【答案】Fe2+ Fe+CuSO4=FeSO4+Cu Fe、Ni、Cu、Ag
【解析】
电路板经过热风处理分为金属板和非金属基材,金属板加入足量的稀硫酸过滤,滤液①中是能和稀盐酸反应的金属溶液:硫酸亚铁、硫酸镍以及过量的稀硫酸;滤渣①中是不能和稀硫酸反应的金属:铜、金和银;滤液①加入过量的铁粉,铁粉将镍离子置换出来,铁粉过量有剩余;滤液②中是硫酸亚铁;滤渣①加入稀硫酸,通入氧气加热,产生滤液③硫酸铜溶液和滤渣:金和银;滤液③硫酸铜溶液中加入足量的铁发生置换反应,生成硫酸亚铁和铜单质。
(1)滤液①加入过量的铁粉,铁粉将镍离子置换出来,形成硫酸亚铁和镍,所以滤液②中金属阳离子符号亚铁离子:Fe2+;
(2)滤液③硫酸铜溶液中加入足量的铁发生置换反应,生成硫酸亚铁和铜单质: Fe+CuSO4=FeSO4+Cu;
(3)铁可以将镍离子置换,镍能与稀硫酸反应产生氢气,所以Fe、Cu、Ag、Ni在溶液中的活动性由强到弱的顺序依次是:Fe、Ni、Cu、Ag。

练习册系列答案
相关题目