题目内容
向两只烧杯中各加入100g 9.8%的稀硫酸,将烧杯分置于天平的两个托盘上,调节天平使之达到平衡,然后向左边烧杯中加入ag镁,向右边烧杯中加入mg铝,充分反应后天平仍然保持平衡.试讨论a和m的取值范围以及两者之间应满足的关系.
(1)当m≥2.4时,a与m的关系式:________.
(2)当m≤1.8时,a与m的关系式:________.
(3)当1.8<m<2.4时,a与m的关系式:________.
解:第一种情况:根据金属过剩,按酸反应完全计算,加入金属质量应符合以下要求:
2Al+3H2SO4═Al2(SO4)3+3H2↑
2×27 3×98 6
1.8g 100g×9.8% 0.2g
Mg+H2SO4═MgSO4+H2↑
24 98 2
2.4g 100g×9.8% 0.2g
100g 9.8%的硫酸至少需要1.8g铝粉参加反应,才能生成0.2g H2
要产生0.2H2,至少需要2.4g镁参加反应,考虑天平平衡a=m≥2.4g,故当m≥2.4时,a与m的关系式a=m.
第二种情况:酸过剩,金属反应完全.而要使金属与100g 9.8%稀硫酸反应使酸过剩,则金属铝的质量必须要小于1.8g,即m≤1.8g;
要使天平平衡,必须满足两烧杯中加入金属质量减去逸出H2的质量差相等,则:
2Al+3H2SO4═Al2(SO4)3+3H2↑
2×27 6
mg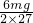
Mg+H2SO4═MgSO4+H2↑
24 2
ag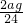
天平平衡必须满足mg-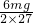 =ag-
=ag-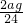 ,则a:m=32:33
,则a:m=32:33
第三种情况:当1.8<m<2.4时,铝过量而镁不足,则由情况一可知过量的铝与稀硫酸反应生成氢气的质量为0.2g.镁不足,则ag镁与硫酸反应生成氢气的质量为
Mg+H2SO4═MgSO4+H2↑
24 2
ag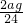
由题意,反应后天平平衡,则mg+100g-0.2g=ag+100g-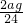
则a与m的关系式:m=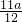 +0.2.
+0.2.
故答案为:(1)a=m;(2)a:m=32:33;(3)m=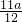 +0.2
+0.2
分析:此题属于金属与酸的反应的讨论题,解题时要分两种情况分析,但不管那种情况则一定符合两烧杯反应前后质量差相等:①金属过量则按酸量计算生成氢气的质量.②酸过量,则按必须满足两烧杯中加入金属质量减去逸出H2的质量差相等,然后利用化学方程式的计算解决问题即可.
点评:此题是一道天平问题的考查题,解题的关键是对天平平衡原因的分析,是一道训练学生思维的好题,但题目难度较大,一般会在竞赛题中出现.
2Al+3H2SO4═Al2(SO4)3+3H2↑
2×27 3×98 6
1.8g 100g×9.8% 0.2g
Mg+H2SO4═MgSO4+H2↑
24 98 2
2.4g 100g×9.8% 0.2g
100g 9.8%的硫酸至少需要1.8g铝粉参加反应,才能生成0.2g H2
要产生0.2H2,至少需要2.4g镁参加反应,考虑天平平衡a=m≥2.4g,故当m≥2.4时,a与m的关系式a=m.
第二种情况:酸过剩,金属反应完全.而要使金属与100g 9.8%稀硫酸反应使酸过剩,则金属铝的质量必须要小于1.8g,即m≤1.8g;
要使天平平衡,必须满足两烧杯中加入金属质量减去逸出H2的质量差相等,则:
2Al+3H2SO4═Al2(SO4)3+3H2↑
2×27 6
mg
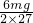
Mg+H2SO4═MgSO4+H2↑
24 2
ag
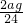
天平平衡必须满足mg-
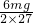 =ag-
=ag-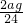 ,则a:m=32:33
,则a:m=32:33第三种情况:当1.8<m<2.4时,铝过量而镁不足,则由情况一可知过量的铝与稀硫酸反应生成氢气的质量为0.2g.镁不足,则ag镁与硫酸反应生成氢气的质量为
Mg+H2SO4═MgSO4+H2↑
24 2
ag
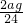
由题意,反应后天平平衡,则mg+100g-0.2g=ag+100g-
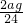
则a与m的关系式:m=
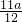 +0.2.
+0.2.故答案为:(1)a=m;(2)a:m=32:33;(3)m=
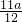 +0.2
+0.2分析:此题属于金属与酸的反应的讨论题,解题时要分两种情况分析,但不管那种情况则一定符合两烧杯反应前后质量差相等:①金属过量则按酸量计算生成氢气的质量.②酸过量,则按必须满足两烧杯中加入金属质量减去逸出H2的质量差相等,然后利用化学方程式的计算解决问题即可.
点评:此题是一道天平问题的考查题,解题的关键是对天平平衡原因的分析,是一道训练学生思维的好题,但题目难度较大,一般会在竞赛题中出现.

练习册系列答案
相关题目