题目内容
某物质4.6克在空气中燃烧生成了8.8克二氧化碳和5.4克水,关于该物质的下列说法正确的是
- A.该物质中一定含的碳元素、氢元素,可能含有氧元素
- B.该物质中一定含有碳元素、氢元素、氧元素
- C.该物质中一定含有碳元素,氢元素,一定没有氧元素
- D.该物质中碳元素与氢元素的原子个数比为1:3
BD
分析:根据质量守恒定律的含义(即六不变)中的“元素的种类不变”可知,生成物所含的碳、氢、氧三种元素中的碳元素和氢元素一定来自于有机物,至于氧元素可能全部来自于氧气,也可能部分来自于氧气,另一部分则来自于4.6g物质,可根据元素的质量不变进行判断;根据生成物CO2和H2O中C、H元素质量,让碳氢元素的质量分别除以各自的相对原子质量再相比,就可以得到该物质中碳氢两元素的原子个数比.
解答:由化合物中某元素的质量=化合物的质量×化合物中该元素的质量分数可知:
8.8g二氧化碳中碳元素的质量=8.8g× ×100%=2.4g;
×100%=2.4g;
5.4g水中氢元素的质量=5.4g×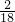 ×100%=0.6g;
×100%=0.6g;
根据质量守恒定律知:生成物中的碳、氢两元素来自该物质,
又由于2.4g+0.6g=3g<4.6g,
说明该物质一定含有碳、氢两元素,而且还一定含有氧元素.所以选项A、C错误,B正确;
该物质中碳、氢元素的原子个数比= :
: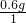 =1:3,所以选项D正确.
=1:3,所以选项D正确.
故选BD.
点评:本题主要考查质量守恒定律的应用及相关计算,根据反应前后元素的质量和种类不变,元素质量比=A相对原子质量×A原子个数:B相对原子质量×B原子个数,推导出:原子个数比= 进行解答,要认真分析.
进行解答,要认真分析.
分析:根据质量守恒定律的含义(即六不变)中的“元素的种类不变”可知,生成物所含的碳、氢、氧三种元素中的碳元素和氢元素一定来自于有机物,至于氧元素可能全部来自于氧气,也可能部分来自于氧气,另一部分则来自于4.6g物质,可根据元素的质量不变进行判断;根据生成物CO2和H2O中C、H元素质量,让碳氢元素的质量分别除以各自的相对原子质量再相比,就可以得到该物质中碳氢两元素的原子个数比.
解答:由化合物中某元素的质量=化合物的质量×化合物中该元素的质量分数可知:
8.8g二氧化碳中碳元素的质量=8.8g×
 ×100%=2.4g;
×100%=2.4g;5.4g水中氢元素的质量=5.4g×
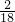 ×100%=0.6g;
×100%=0.6g;根据质量守恒定律知:生成物中的碳、氢两元素来自该物质,
又由于2.4g+0.6g=3g<4.6g,
说明该物质一定含有碳、氢两元素,而且还一定含有氧元素.所以选项A、C错误,B正确;
该物质中碳、氢元素的原子个数比=
 :
: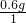 =1:3,所以选项D正确.
=1:3,所以选项D正确.故选BD.
点评:本题主要考查质量守恒定律的应用及相关计算,根据反应前后元素的质量和种类不变,元素质量比=A相对原子质量×A原子个数:B相对原子质量×B原子个数,推导出:原子个数比=
 进行解答,要认真分析.
进行解答,要认真分析. 
练习册系列答案
相关题目