题目内容
【题目】化学小组用如图所示装置研究酸碱盐的性质(夹持仪器已省略)。
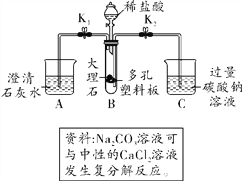
(1)关闭K2,打开K1和分液漏斗玻璃塞、活塞,向B装置中加入稀盐酸,使其浸没大理石后关闭分液漏斗活塞。A中反应的化学方程式为______________,B中发生反应的化学方程式为______________。
(2)当B中物质仍在反应时,关闭K1,打开K2。一段时间后C中的现象为__________;充分反应后,C中一定含有溶质NaCl的原因是___________________________。
【答案】 CO2+Ca(OH)2=== CaCO3↓+H2O CaCO3+2HCl=== CaCl2+H2O+CO2↑ C中液面升高,先有气泡冒出,后产生白色沉淀 B中的CaCl2和HCl分别与C中的Na2CO3反应生成NaCl
【解析】(1)二氧化碳与氢氧化钙反应生成碳酸钙白色沉淀和水,用碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳;(2)当B装置中的物质仍在反应时,关闭止水夹K1,二氧化碳无法排出,打开止水夹K2,则B中压强增大,会将B中液体压入到C中,氯化钙、盐酸进入C中,盐酸、氯化钙都和C中碳酸钠反应都能产生氯化钠。(1)A中发生的反应是二氧化碳与澄清石灰水的主要成分氢氧化钙反应生成碳酸钙白色沉淀和水,方程式是:CO2+Ca(OH)2═CaCO3↓+H2O;B中碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,方程式是:CaCO3+2HCl═CaCl2+H2O+CO2↑;(2)当B装置中的物质仍在反应时,关闭止水夹K1,二氧化碳无法排出,打开止水夹K2,则B中压强增大,会将B中液体压入到C中,氯化钙、盐酸进入C中,盐酸、氯化钙分别和C中碳酸钠反应都能产生二氧化碳气体和碳酸钙沉淀,因此观察到C中液面升高,先有气泡冒出,后产生白色沉淀;溶液中一定含有氯化钠,是因为B中的CaCl2和HCl分别与C中Na2CO3反应生成NaCl。

 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案