题目内容
 如图,将乙针筒内的物质压到甲针筒内,进行下表所列实验,对实验现象的描述错误的是 如图,将乙针筒内的物质压到甲针筒内,进行下表所列实验,对实验现象的描述错误的是
|
B、氢气和氧气在常温下不能发生反应,不能生成无色液体,由于分子之间有间隔,混合后活塞略微向内压缩,故B错;
C、硫酸铁和氢氧化钡反应生成氢氧化铁红褐色沉淀和硫酸钡白色沉淀,故C正确;
D、因铁与硫酸反应生成硫酸亚铁和氢气,所以有气体生成,溶液呈浅绿色,产生了气体,压强增大,活塞自动外移,设1g铁粉完全反应消耗硫酸的质量为X则:
Fe+H2SO4═FeSO4+H2↑
56 98
1g X
根据
| 56 |
| 98 |
| 1g |
| X |
故选:B.

 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
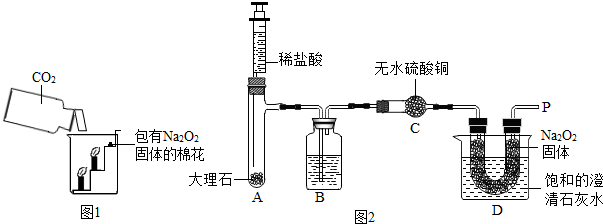
一课一练课时达标系列答案过氧化钠(Na2O2)是一种淡黄色固体。在一次科技活动中,同学们将包有Na2O2固体的棉花放入了如右图所示的装置中,发现高低不同的两根蜡烛,下面的蜡烛先熄灭,上面的蜡烛后熄灭,同时也惊奇地发现棉花燃烧了起来。
(1)实验过程中蜡烛由下往上依次熄灭,说明二氧化碳
具有 的性质。
(2)棉花为什么会燃烧呢?同学们认为棉花要燃烧,除了满足棉花是可燃物之外,还需
满足 、  。
。
【提出问题】上述实验中是如何给棉花提供燃烧条件的?
【查阅资料】1.在常温下Na2O2与CO2、H2O均能发生化学反应。
2.无水硫酸铜为白色固体,吸水后变为蓝色。
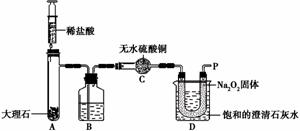
【实验设计】经过讨论,同学们设计用下图所示装置进行实验探究。
 | |||
 | |||
【实验步骤】①检查整套装置的气密性; ②把相关的试剂放入对应的仪器内;
③用力推动针筒的活塞,把稀盐酸注入试管内;
④一段时间后,在P处放 置一根带火星的木条,观察现
置一根带火星的木条,观察现 象。
象。
注意:大理石与稀盐酸制取的CO2还会含有一定量的水蒸气,但整个实验过程中不考虑稀盐酸的挥发和空气对实验的影响。
【实验现象】
①带火星的木条复燃; ②无水硫酸铜没有变蓝色; ③饱和的澄清石灰水变浑浊。
【实验分析】①B装置内盛放的试剂是 ;②D装置烧杯内澄清石灰水变浑浊的原因可能是 ,也可能是空气中的CO2与澄清石灰水反应生成了难溶物使澄清石灰水变混浊。
【实 验结论】
验结论】 ①Na2O2和CO2反应产生的一种气体,使图1中的棉花满足了燃烧的一个条件。
①Na2O2和CO2反应产生的一种气体,使图1中的棉花满足了燃烧的一个条件。
②Na2O2和CO2反应过程中伴随能量变化,使图1中的棉花满足了燃烧的另一个条件。
【拓展提高】①Na2O2和CO2反应除生成一种气体外,还生成了一种固体,学生甲认为生成的固体是NaOH,学生乙认为是Na2CO3,同学们经思考后认为甲同学的猜想是错误的,理由是 。
②写出Na2O2和CO2反应的化学方程式  。
。
【定量探究】有一包久置的过氧化钠粉末,现已证明因其保存不当导致完全变质成为NaOH和Na2CO3的混合物,同学们称取了13.25g样品,加入足量稀盐酸,并将产生的气体通入足量的澄清石灰水中,得到白色沉淀,经过滤、洗涤、烘干后称得其质量为10g,试计算:样品中Na2CO3的质量分数。
友情小帖:在同温同压下任何相同体积的气体具有相同的分子数.例如:同温同压下1L氢气所含有的氢气分子数与1L氧气所含的氧气分子数相同.

(1)请你帮小高同学分析:X气体是 (写化学式);若该反应的化学方程式为:a Na2O2+b CO2═c X+d Y(其中a、b、c、d为系数),则b:c= .
(2)小高同学猜测白色物质Y可能是Na2CO3.小淳同学用气密性良好的如图2装置,从以下四种溶液中选择合适的试剂实验,验证了该同学的猜想.供选择的试剂:
①稀硫酸 ②氢氧化钠溶液 ③澄清石灰水 ④硫酸铜溶液
| 操作 | 现象 | 化学方程式 |
| 甲中加入白色物质Y,乙中加入 (填试剂序号,下同),再向甲中加入 . | 甲中产生气泡;乙中产生白色沉淀. | 甲中 ; 乙中 . |