��Ŀ����
����ʵ��װ���dz��л�ѧʵ���ҳ���װ�ã���A�⣩��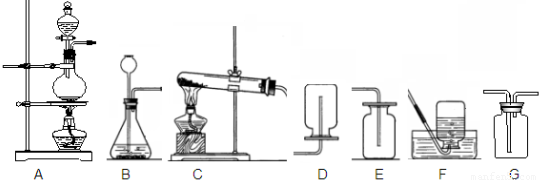
�������ʵ�����������ʶ���ش��������⣺
��1��ѡ��C��G��______��ϳ�װ�ÿ���ȡ�����������
��2��ѡB����ȡ����ķ���װ�ã�Ӧ�����������______��
��3������Gװ���ռ�������̼���ӷ���װ�ò����Ķ�����̼Ӧ��G��______������ҡ�����ͨ�룬�������������̼�ǷM�IJ�����______��
��4��Cװ�������Ľ��������������ԭ����ͭʵ�飬�Ľ�������______
______��
�������ʵ��ԭ����������о������Խ���������⣺
ʵ��������װ��A�������ᣨHCOOH����Ũ�������ˮ�����£���ȡCO��ʵ����Ϊ��ʹ��Ӧ�ٶ����Լӿ죬���ȶ�Ũ�������Ԥ�ȣ�����Ũ�����еμӼ��ᣮ��Ӧ�Ļ�ѧ����ʽΪ��
HCOOH
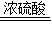 H2O+CO��
H2O+CO����5�����ᣨHCOOH��������̼Ԫ�صĻ��ϼ�Ϊ______��
��6���ռ�CO��װ��Ӧѡ��______������ţ�װ�ã�
��7������Ϊ��ȼCOǰ������еIJ�����______��
��8������Ϊ����ȡH2��ȣ���ȡCO��ʵ��Ҫע��______��
���𰸡���������1����ȡ������������ſ�������
��2��ѡ������ķ���װ�ø��ݷ�Ӧ���״̬�ͷ�Ӧ������
��3�����ݶ�����̼���ܶȱȿ���������̼����ȼ�ա�����֧��ȼ�յ����ʽ��з������
��4������������ԭ����ͭ��װ���ص���иĽ���
��5�����ݻ�����������Ԫ�ػ��ϼ��ܺ�Ϊ0���н��
��6������һ����̼�������ж��ռ�������
��7����ȼ�������ڵ�ȼǰ����Ҫ�鴿����ֹ������ը��
��8������һ����̼�ж����з�����
����⣺��1����ȡ������������ſ��������������ܶȱȿ��������Կ���CE��ϣ�
�ʴ�Ϊ��CE��
��2��B ����װ���ʺϹ�����Һ���ϳ��¼��ɷ����ķ�Ӧ��
�ʴ�Ϊ����״�����״�����ڳ�������Һ�巴Ӧ��
��3��������̼���ܶȱȿ����������������ߵĵ��ܽ��룬������̼����ȼ�ա�����֧��ȼ�գ����Կ���ȼ�ŵ�ľ�������ұߵ��ܿڽ����������ұߵ����������ſ����ģ���ľ��Ϩ��˵���ռ����ˣ�
�ʴ�Ϊ���� ��ȼ�ŵ�ľ���ӽ��ұߵĵ��ܣ������Ƿ�Ϩ��
��4��������ԭ����ͭ����Ҫ���Թ��ڵĿ����ž�������Ӧ�ε����ӣ�Ϊ��������ͭ��������ַ�Ӧ������Ҫ���뵽����ͭ���Ϸ���
�ʴ�Ϊ��������Ƥ�������������뵽CuO���Ϸ���
��5�����ݻ�����������Ԫ�ػ��ϼ��ܺ�Ϊ0��ԭ����Ԫ�صĻ��ϼ�Ϊ+1�ۣ���Ԫ�صĻ��ϼ���-2�ۣ�����̼Ԫ�صĻ��ϼ���+2�ۣ�
�ʴ�Ϊ��+2��
��6��һ����̼���ܶȱȿ�����С�����ж����ʲ����ſ������ռ���һ����̼������ˮ��������ˮ���ռ���
��ѡ��F��
��7����ȼ�������ڵ�ȼǰ����Ҫ�鴿����ֹ��ȼ�������������������Ϸ�����ը��
�ʴ�Ϊ���鴿
��8��һ����̼�ж�����������ȡһ����̼ʱҪע���ֹһ����̼й©�Ӷ���Ⱦ������
�ʴ�Ϊ����ֹCOй©��Ⱦ������
���������⿼��֪ʶ�ۺ϶�ȫ�棬�ܺܺõĿ����ѧ������ѧ֪ʶ�����պ�Ӧ�������
��2��ѡ������ķ���װ�ø��ݷ�Ӧ���״̬�ͷ�Ӧ������
��3�����ݶ�����̼���ܶȱȿ���������̼����ȼ�ա�����֧��ȼ�յ����ʽ��з������
��4������������ԭ����ͭ��װ���ص���иĽ���
��5�����ݻ�����������Ԫ�ػ��ϼ��ܺ�Ϊ0���н��
��6������һ����̼�������ж��ռ�������
��7����ȼ�������ڵ�ȼǰ����Ҫ�鴿����ֹ������ը��
��8������һ����̼�ж����з�����
����⣺��1����ȡ������������ſ��������������ܶȱȿ��������Կ���CE��ϣ�
�ʴ�Ϊ��CE��
��2��B ����װ���ʺϹ�����Һ���ϳ��¼��ɷ����ķ�Ӧ��
�ʴ�Ϊ����״�����״�����ڳ�������Һ�巴Ӧ��
��3��������̼���ܶȱȿ����������������ߵĵ��ܽ��룬������̼����ȼ�ա�����֧��ȼ�գ����Կ���ȼ�ŵ�ľ�������ұߵ��ܿڽ����������ұߵ����������ſ����ģ���ľ��Ϩ��˵���ռ����ˣ�
�ʴ�Ϊ���� ��ȼ�ŵ�ľ���ӽ��ұߵĵ��ܣ������Ƿ�Ϩ��
��4��������ԭ����ͭ����Ҫ���Թ��ڵĿ����ž�������Ӧ�ε����ӣ�Ϊ��������ͭ��������ַ�Ӧ������Ҫ���뵽����ͭ���Ϸ���
�ʴ�Ϊ��������Ƥ�������������뵽CuO���Ϸ���
��5�����ݻ�����������Ԫ�ػ��ϼ��ܺ�Ϊ0��ԭ����Ԫ�صĻ��ϼ�Ϊ+1�ۣ���Ԫ�صĻ��ϼ���-2�ۣ�����̼Ԫ�صĻ��ϼ���+2�ۣ�
�ʴ�Ϊ��+2��
��6��һ����̼���ܶȱȿ�����С�����ж����ʲ����ſ������ռ���һ����̼������ˮ��������ˮ���ռ���
��ѡ��F��
��7����ȼ�������ڵ�ȼǰ����Ҫ�鴿����ֹ��ȼ�������������������Ϸ�����ը��
�ʴ�Ϊ���鴿
��8��һ����̼�ж�����������ȡһ����̼ʱҪע���ֹһ����̼й©�Ӷ���Ⱦ������
�ʴ�Ϊ����ֹCOй©��Ⱦ������
���������⿼��֪ʶ�ۺ϶�ȫ�棬�ܺܺõĿ����ѧ������ѧ֪ʶ�����պ�Ӧ�������

��ϰ��ϵ�д�
�����Ŀ
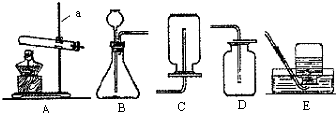
��ѧʵ��Ϳ�ѧ̽�����벻��ʵ��װ�ã���������װ�ûش����⣺

��1������a�������� ��
��2���ڳ��п�ͬʱ������ȡO2��CO2��H2�ķ���װ���� ������ĸ��������ȡH2�Ļ�ѧ����ʽΪZn+H2SO4=ZnSO4+H2�������ռ�CO2��װ���� ��
��3������Bװ����ȡ��������Ӧ�Ļ�ѧ����ʽ�� ����Ӧ�У�MnO2�� ���ã��ӿ���H2O2�ķֽ⣮
��4�������£���Ȳ��C2H2����һ����ɫ���壬�ܶȱȿ�����С��������ˮ��ʵ���ҳ���̼���ƹ����뱥��ʳ��ˮ��Ӧ����ȡ��Ȳ����ѡ����ʵ�װ������ȡ���ռ���Ȳ��Ӧ��ѡ��ķ���װ���� ������ţ���ͬ�����ռ�װ���� ��
��5����ѧ̽��
[��������]
С��ͬѧ�������Ϸ��֣��������ƣ�CaO2���ֱܷ���ˮ��������̼��Ӧ��
[����]
�ٹ���������ˮ��Ӧ�����������ƺ�������
�ڹ��������ڿ����о������ɵ����ʿ�����̼��ƻ��������ƻ���ߵĻ���
[ʵ��̽��]
ʵ��һ��ѡ������ʵ��װ��B���й���������ˮ��Ӧ��ʵ�飬�ռ�һ�Թ����壬������ �ǵ�ľ�������Թ��У�ľ����ȼ��ȡ��Ӧ�����Һ�����Թ��У�������ٵ��� ����дһ���Լ������ƣ���Һ��������Һ��ɺ�ɫ��˵�����������ȷ�ģ���Ӧ�Ļ�ѧ����ʽ�� ��
ʵ�����Ϊ̽��������Ƿ���ȷ��С�����������ʵ�飬�����������ɱ����еĿհ����ݣ�
ʵ�鲽��c�з�����Ӧ�Ļ�ѧ����ʽ�� ��

��1������a�������� ��
��2���ڳ��п�ͬʱ������ȡO2��CO2��H2�ķ���װ���� ������ĸ��������ȡH2�Ļ�ѧ����ʽΪZn+H2SO4=ZnSO4+H2�������ռ�CO2��װ���� ��
��3������Bװ����ȡ��������Ӧ�Ļ�ѧ����ʽ�� ����Ӧ�У�MnO2�� ���ã��ӿ���H2O2�ķֽ⣮
��4�������£���Ȳ��C2H2����һ����ɫ���壬�ܶȱȿ�����С��������ˮ��ʵ���ҳ���̼���ƹ����뱥��ʳ��ˮ��Ӧ����ȡ��Ȳ����ѡ����ʵ�װ������ȡ���ռ���Ȳ��Ӧ��ѡ��ķ���װ���� ������ţ���ͬ�����ռ�װ���� ��
��5����ѧ̽��
[��������]
С��ͬѧ�������Ϸ��֣��������ƣ�CaO2���ֱܷ���ˮ��������̼��Ӧ��
[����]
�ٹ���������ˮ��Ӧ�����������ƺ�������
�ڹ��������ڿ����о������ɵ����ʿ�����̼��ƻ��������ƻ���ߵĻ���
[ʵ��̽��]
ʵ��һ��ѡ������ʵ��װ��B���й���������ˮ��Ӧ��ʵ�飬�ռ�һ�Թ����壬������ �ǵ�ľ�������Թ��У�ľ����ȼ��ȡ��Ӧ�����Һ�����Թ��У�������ٵ��� ����дһ���Լ������ƣ���Һ��������Һ��ɺ�ɫ��˵�����������ȷ�ģ���Ӧ�Ļ�ѧ����ʽ�� ��
ʵ�����Ϊ̽��������Ƿ���ȷ��С�����������ʵ�飬�����������ɱ����еĿհ����ݣ�
| ʵ�鲽�� | ʵ������ | ���� |
| a��ȡ�ڿ������õ������������Թ��У�������ˮ | δ�����������ܽ� | / |
| b�����Թ��еμ���ɫʯ����Һ | δ�����Ե���ɫ�仯 | �������������� |
| c�� | ����ɷ���̼��� |


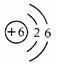 A��̼Ԫ�����ڷǽ���Ԫ��
A��̼Ԫ�����ڷǽ���Ԫ��


 B��̼ԭ�Ӻ���������Ϊ6
B��̼ԭ�Ӻ���������Ϊ6


