题目内容
(5分)最近,“铬超标胶囊”事件引起社会强烈关注。铬的毒性与其价态及含量有关。铬常用作合金的生产原料,铬元素也是哺乳动物所需的微量元素之一。下图是铬在元素周期表中的相关信息,请回答:

(1)铬原子的核电荷数是 ;其相对原子质量为 。
(2)酒精监测仪中的反应原理为:C2H5OH+4X(红棕色)+ 6H2SO4 ="==2" Cr2 (SO4)3(绿色) + 2CO2↑+ 9H2O,则物质X的化学式为 ;Cr2 (SO4)3中Cr的化合价为 。
(3)据此信息,就物质或元素的安全性谈谈你的看法: 。

(1)铬原子的核电荷数是 ;其相对原子质量为 。
(2)酒精监测仪中的反应原理为:C2H5OH+4X(红棕色)+ 6H2SO4 ="==2" Cr2 (SO4)3(绿色) + 2CO2↑+ 9H2O,则物质X的化学式为 ;Cr2 (SO4)3中Cr的化合价为 。
(3)据此信息,就物质或元素的安全性谈谈你的看法: 。
(1)24,52.00 (2)CrO3, +3价
(3)从物质、元素的利弊观或适量原则等角度回答均
(3)从物质、元素的利弊观或适量原则等角度回答均
(1)根据铬元素相关信息可知原子序数=质子数=核电荷数=24,相对原子量为52.00
(2)根据质量守恒定律可知,反应前后原子的种类没有改变,数目没有增减,故:反应前已知的原子个数:碳原子2个、氢原子18个、氧原子25个、硫原子6个;反应后原子个数:铬原子4个、硫原子6个、氧原子37个、碳原子2个、氢原子18个,故可知4X中含有铬原子4个和12个氧原子,故物质X的化学式为CrO3.
根据在化合物中正负化合价代数和为零,硫酸根显-2价,设铬元素的化合价是x,可知Cr2 (SO4)3中铬元素的化合价:2x+(-2)×3=0,则x=+3.
(3)从物质、元素的利弊观或适量原则等角度回答均
(2)根据质量守恒定律可知,反应前后原子的种类没有改变,数目没有增减,故:反应前已知的原子个数:碳原子2个、氢原子18个、氧原子25个、硫原子6个;反应后原子个数:铬原子4个、硫原子6个、氧原子37个、碳原子2个、氢原子18个,故可知4X中含有铬原子4个和12个氧原子,故物质X的化学式为CrO3.
根据在化合物中正负化合价代数和为零,硫酸根显-2价,设铬元素的化合价是x,可知Cr2 (SO4)3中铬元素的化合价:2x+(-2)×3=0,则x=+3.
(3)从物质、元素的利弊观或适量原则等角度回答均

练习册系列答案
相关题目
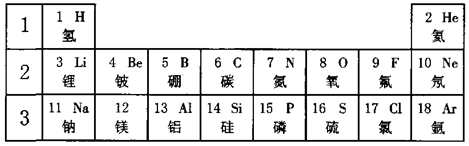
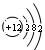 ,在化学反应中该原子易 (填“得到”或“失去”)电子。13号元素属于 (填“金属”或“非金属”)元素。
,在化学反应中该原子易 (填“得到”或“失去”)电子。13号元素属于 (填“金属”或“非金属”)元素。