题目内容
硫化氢(H2S) 是一种没有颜色,具有臭鸡蛋气味的有毒气体,其密度比空气大,且能溶于水形成氢硫酸,在空气中点燃硫化氢气体有SO2和水生成.实验室通常用块状固体硫化亚铁(FeS)与稀硫酸混合,在常温下发生复分解反应,制得硫化氢气体,试回答:
(1)写出硫化氢在空气中燃烧的化学方程式______.
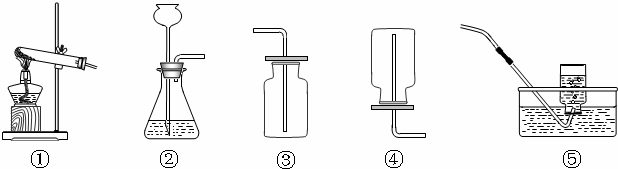
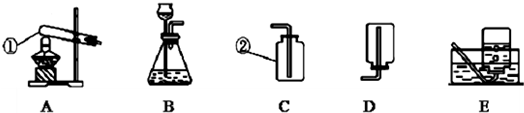
(2)根据装置图(图1)回答下列问题:
①制取H2S气体的发生装置 可选用______.
②若用C装置收集H2S气体,进气口应为______.
③为了验证硫化氢的水溶液呈酸性,可将气体通入装置D,则D中所盛的试剂应该是______.
④做上述实验时,为了防止多余的H2S气体逸出污染环境,可将其通入装置E吸收.E中试剂为______.?
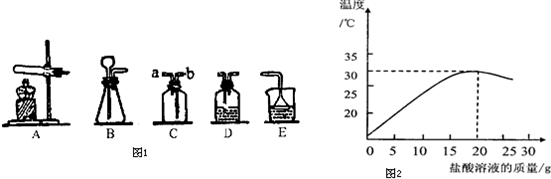
(3)某化学兴趣小组的同学在实验室配制溶质质量分数为7.3%的稀盐酸,并用其测定某氢氧化钠溶液溶质的质量分数.图2表示用上述配制的稀盐酸与40g某氢氧化钠溶液发生反应过程中,使用数字传感仪测得溶液温度变化的曲线.
①该图象说明中和反应______,(放热或吸热)
②当加入25g盐酸溶液时,所得溶液中的微粒有:______(用化学符号表示).
③试某氢氧化钠溶液的溶质质量分数.
解:(1)硫化氢气体在空气中燃烧生成的是水和二氧化硫;反应方程式为:2H2S+3O2 2SO2+2H2O;
2SO2+2H2O;
(2)①制取硫化氢是用的固态硫化亚铁和液态稀硫酸,而且反应不需要加热;所以气体发生装置可以选择制B装置;
②y因为硫化氢密度比空气大,若用C装置收集H2S气体,进气口应为长管b;
③酸能使紫色石蕊试液变红,为了验证硫化氢的水溶液呈酸性,可将气体通入装置D.D中所盛的试剂应该是紫色石蕊试剂;反应现象为溶液变红;
④硫化氢溶于水形成酸,所以用碱液吸收,所以为了防止多余的H2S气体逸出污染环境,可将其通入装置E吸收.E中试剂为NaOH溶液;
(3)①观察坐标看出随着盐酸的加入,发生中和反应,溶液的温度逐渐升高,因此反应是放热的;
②由于盐酸与氢氧化钠反应生成氯化钠和水,加入25g盐酸溶液时盐酸过量,所以反应后的溶液中含有氯化钠、盐酸,氯化钠电离出钠离子和氯离子,盐酸中电离出氢离子和氯离子,溶液中还存在水分子;
③解:设40克该氢氧化钠溶液中溶质的质量为x,根据题意可知加入盐酸为20克时恰好完全反应
NaOH+HCl═NaCl+H2O
40 36.5
x 20gⅹ7.3%
 =
=
x=1.6 g
氢氧化钠溶液的溶质质量分数: ⅹ100%=4%
ⅹ100%=4%
答:该氢氧化钠溶液中溶质质量分数4%.
故答案为:(1)2H2S+3O2 2SO2+2H2O;
2SO2+2H2O;
(2)①B; ②b; ③紫色石蕊试液; ④氢氧化钠溶液(其他合理答案均可)
(3)①放热;②H2O、Na+、Cl-和H+
③解:设40克该氢氧化钠溶液中溶质的质量为x,根据题意可知加入盐酸为20克时恰好完全反应
NaOH+HCl═NaCl+H2O
40 36.5
x 20gⅹ7.3%
 =
=
x=1.6 g
氢氧化钠溶液的溶质质量分数: ⅹ100%=4%
ⅹ100%=4%
答:该氢氧化钠溶液中溶质质量分数4%.
分析:(1)根据硫化氢燃烧的反应实际是硫化氢与空气中的氧气反应生成水和二氧化硫的反应,据此即可写出反应的化学方程式;
(2)实验室是用硫化亚铁和硫酸反应生成硫酸亚铁和硫化氢气体:
①根据反应物的状态和反应的条件可以选择气体的发生装置;②根据气体密度与空气密度的比较可以选择气体的收集装置;③根据酸能使紫色石蕊试液变红进行解答;④根据硫化氢溶于水形成酸,所以用碱液吸收进行解答;
(3)①根据坐标分析热量变化来考虑;②加入25g盐酸溶液时盐酸过量,通过分析反应后存在的溶质考虑溶液中的离子;③根据图象可知反应完毕消耗盐酸的质量为20g,再乘以盐酸的质量分数,算出氯化氢的质量,再通过计算算出氢氧化钠的质量,再除以氢氧化钠溶液的质量即可.
点评:掌握常见的发生装置和收集装置,能够根据反应物的状态和反应条件,来选择合适的发生装置,根据气体的密度及水溶性来选择收集装置;在分析中和反应时,反应后溶液中的离子要考虑反应后溶液中的溶质;解答本题还需要结合图表中数据分析出参加反应的氯化氢的质量.
 2SO2+2H2O;
2SO2+2H2O;(2)①制取硫化氢是用的固态硫化亚铁和液态稀硫酸,而且反应不需要加热;所以气体发生装置可以选择制B装置;
②y因为硫化氢密度比空气大,若用C装置收集H2S气体,进气口应为长管b;
③酸能使紫色石蕊试液变红,为了验证硫化氢的水溶液呈酸性,可将气体通入装置D.D中所盛的试剂应该是紫色石蕊试剂;反应现象为溶液变红;
④硫化氢溶于水形成酸,所以用碱液吸收,所以为了防止多余的H2S气体逸出污染环境,可将其通入装置E吸收.E中试剂为NaOH溶液;
(3)①观察坐标看出随着盐酸的加入,发生中和反应,溶液的温度逐渐升高,因此反应是放热的;
②由于盐酸与氢氧化钠反应生成氯化钠和水,加入25g盐酸溶液时盐酸过量,所以反应后的溶液中含有氯化钠、盐酸,氯化钠电离出钠离子和氯离子,盐酸中电离出氢离子和氯离子,溶液中还存在水分子;
③解:设40克该氢氧化钠溶液中溶质的质量为x,根据题意可知加入盐酸为20克时恰好完全反应
NaOH+HCl═NaCl+H2O
40 36.5
x 20gⅹ7.3%
 =
=
x=1.6 g
氢氧化钠溶液的溶质质量分数:
 ⅹ100%=4%
ⅹ100%=4% 答:该氢氧化钠溶液中溶质质量分数4%.
故答案为:(1)2H2S+3O2
 2SO2+2H2O;
2SO2+2H2O;(2)①B; ②b; ③紫色石蕊试液; ④氢氧化钠溶液(其他合理答案均可)
(3)①放热;②H2O、Na+、Cl-和H+
③解:设40克该氢氧化钠溶液中溶质的质量为x,根据题意可知加入盐酸为20克时恰好完全反应
NaOH+HCl═NaCl+H2O
40 36.5
x 20gⅹ7.3%
 =
=
x=1.6 g
氢氧化钠溶液的溶质质量分数:
 ⅹ100%=4%
ⅹ100%=4% 答:该氢氧化钠溶液中溶质质量分数4%.
分析:(1)根据硫化氢燃烧的反应实际是硫化氢与空气中的氧气反应生成水和二氧化硫的反应,据此即可写出反应的化学方程式;
(2)实验室是用硫化亚铁和硫酸反应生成硫酸亚铁和硫化氢气体:
①根据反应物的状态和反应的条件可以选择气体的发生装置;②根据气体密度与空气密度的比较可以选择气体的收集装置;③根据酸能使紫色石蕊试液变红进行解答;④根据硫化氢溶于水形成酸,所以用碱液吸收进行解答;
(3)①根据坐标分析热量变化来考虑;②加入25g盐酸溶液时盐酸过量,通过分析反应后存在的溶质考虑溶液中的离子;③根据图象可知反应完毕消耗盐酸的质量为20g,再乘以盐酸的质量分数,算出氯化氢的质量,再通过计算算出氢氧化钠的质量,再除以氢氧化钠溶液的质量即可.
点评:掌握常见的发生装置和收集装置,能够根据反应物的状态和反应条件,来选择合适的发生装置,根据气体的密度及水溶性来选择收集装置;在分析中和反应时,反应后溶液中的离子要考虑反应后溶液中的溶质;解答本题还需要结合图表中数据分析出参加反应的氯化氢的质量.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
二氧化硫是一种有刺激性气味的气体,其水溶液叫亚硫酸(H2SO3);硫化氢(H2S)是一种具有臭鸡蛋气味的气体,其水溶液叫氢硫酸(H2S);又知相同条件下氢硫酸的酸性小于亚硫酸.室温下向饱和H2SO3溶液通入过量H2S气体,反应的化学方程式为:2H2S+H2SO3?3S↓+3H2O.从以上信息得出的下列结论中,不正确的是( )
| A、反应后液体仍然为酸性 | B、“臭鸡蛋气味的气体”描述的是硫化氢的物理性质 | C、SO2与水反应生成亚硫酸,说明SO2与CO2有相似的化学性质 | D、在H2S与H2SO3的反应中,硫元素的化合价升高了 |