题目内容
根据右图判断,下列说法错误的是( )
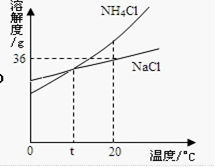
A.NaCl和NH4Cl的溶解度都随温度升高而增大
B.20 ℃时,18g NaCl加入到50 g水中,搅拌后将全部溶解
C.t ℃时,NH4C1饱和溶液和NaCl饱和溶液溶质质量分数相等
D.将20 ℃时某NH4Cl溶液降温到0 ℃,其溶质质量分数一定减小了
D
【解析】
试题分析:如图可知A项正确;20 ℃时,NaCl的溶解度为36g,也就是说100g水中最多可以溶解36g溶质,所以20 ℃时50g水中最多可以溶解18g NaCl,B项正确;如图t ℃时,NH4C1饱和溶液和NaCl饱和溶液溶解度相等,溶质和溶剂质量比相等,所以质量分数也相等;
要想只改变温度降低溶液的质量分数,则溶质必须从溶液中析出,如果此NH4Cl溶液在降低温度的过程中一直没有溶质析出则其溶质质量分数不变。
考点:溶解度曲线的意义
点评:关于溶解度曲线的题目属于中考必考的题型,通常在选择题较为靠后的位置出现,有一定的难度,考生应熟知基础知识点,仔细审题,理解其曲线的含义。

 应用题作业本系列答案
应用题作业本系列答案24.(5分)我们的衣食住行与化学知识密不可分。请根据下列生活中的事实填空。
(1)下列各类食物中蛋白质含量最丰富的是 。
|
①草莓 |
②西红柿 |
③米饭 |
④鸡蛋 |
(2)人体缺乏碘元素易引起甲状腺肿大,碘元素在周期表中的信息如右图所示。
则下列说法错误的是 。
|
①加碘食盐中的碘是指碘单质 ②碘的原子序数是53
③碘元素主要存在于新鲜蔬菜、瓜果中 ④碘的相对原子质量是126.9
(3) 家庭生活中常使用下列用品,其中用到有机合成材料的是 。

①不锈钢炊具 ②合成橡胶手套 ③纯棉饰品 ④塑料外壳电话
(4)“可燃冰”[CH4·(H2O) n ]是一种沉睡在海底和高寒冻土的独特能源。2007年5月,在我国南海北部成功钻获“可燃冰”样品。下列有关“可燃冰”的说法正确的是 。
①属于海底生物 ②说明水可以变成油
③CH4·(H2O) n属于化合物 ④是燃烧值高、污染少的新能源
(5)右图是贴在某汽车加油站的广告。判断以下叙述正确的是 。
①玉米汁可用作汽车燃料
②由玉米生产的酒精汽油可作汽车燃料
③推广玉米生产的燃料可在一定程度上缓解当前的能源危机
④以农作物为原料来生产化学品是可行的
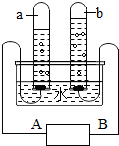 如右图所示,是通电分解水的实验装置图,请回答下列问题:
如右图所示,是通电分解水的实验装置图,请回答下列问题: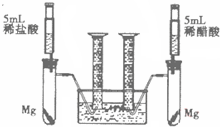 某校化学兴趣小组对金属活动性顺序等知识进行了研究.
某校化学兴趣小组对金属活动性顺序等知识进行了研究.