题目内容
化学小组同学为鉴定某工厂排出的无色污水成分,他们查阅工厂的有关资料后,推测出污水中可能含有HCl、Na2SO4、NaOH、Na2CO3中的一种或几种物质,同学们取污水进行了探究:(已知Na2SO4溶液呈中性)
(1)测污水的pH:取一张pH试纸,放在玻璃片上________________________,读数为pH=2,由此可知:污水中一定有_____________,可能有Na2SO4。
(2)检验Na2SO4是否存在:甲同学在一支试管中取少量污水,向试管中滴加少量的_______________溶液,振荡,产生了白色沉淀,反应的化学方程式为____________________,证明污水中有Na2SO4存在。乙同学用物理方法也得到了同样的结论,他的实验操作及实验现象是_____________________________。
通过探究,同学们确定了污水的成分。
为使排放的污水中不含酸或碱,可向污水中加过量的________________________。
(1)测污水的pH:取一张pH试纸,放在玻璃片上________________________,读数为pH=2,由此可知:污水中一定有_____________,可能有Na2SO4。
(2)检验Na2SO4是否存在:甲同学在一支试管中取少量污水,向试管中滴加少量的_______________溶液,振荡,产生了白色沉淀,反应的化学方程式为____________________,证明污水中有Na2SO4存在。乙同学用物理方法也得到了同样的结论,他的实验操作及实验现象是_____________________________。
通过探究,同学们确定了污水的成分。
为使排放的污水中不含酸或碱,可向污水中加过量的________________________。
(1)用玻璃棒蘸取污水样品,滴在pH试纸上,与标准比色卡比较 HCl
(2) BaCl2【Ba(OH)2或Ba(NO3)2】 BaCl2+Na2SO4=BaSO4↓+2 NaCl(合理即可)
在试管中取少量污水蒸干(或玻璃片上滴几滴污水晾干),有白色固体析出
(2) BaCl2【Ba(OH)2或Ba(NO3)2】 BaCl2+Na2SO4=BaSO4↓+2 NaCl(合理即可)
在试管中取少量污水蒸干(或玻璃片上滴几滴污水晾干),有白色固体析出
正确的PH值的测定方法是用玻璃棒蘸取少量的待测液体涂在PH试纸上,观察颜色的变化,再与标准比色卡对照;测出溶液的PH=2,说明溶液呈酸性,由此可确定溶液中一定有盐酸,同时可根据离子共存的原理排除氢氧化钠和碳酸钠;硫酸钠的证明实质是证明溶液中存在硫酸根离子,可以含钡离子的盐或碱来证明,生成白色沉淀,且沉淀不溶于酸即可证明,物理方法是蒸发,出现白色固体即可。

练习册系列答案
相关题目


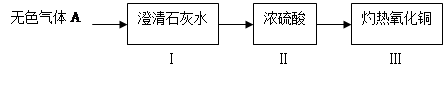
 2Fe+3CO2,请写出反应器中一氧化碳是如何产生的化学方程式: 。
2Fe+3CO2,请写出反应器中一氧化碳是如何产生的化学方程式: 。