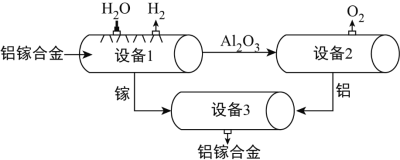
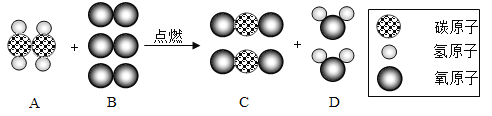
��Ŀ����
����Ŀ������п��ZnO����һ�������İ�ɫ�����ϣ�������п�ס���ҵ���ú������������п��Һ��ȡп�۵�����������ͼ��
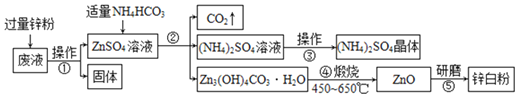
��1���������п�۵�Ŀ����______����Ӧ�Ļ�ѧ����ʽΪ______��
��2��������������������______����������������______�����½ᾧ���Ƶþ�����ũҵ�ϵ���;��______��������ĥ��ʵ�����г��õ�������______��
��3������Zn3(OH)4CO3H2Oʱ�ֽⷴӦ�Ļ�ѧ����ʽ��______��
���𰸡���ȥ���� Zn+H2SO4=ZnSO4+H2�� ���� ������Ũ���� ���ʣ��ʣ� �в� Zn3(OH)4CO3H2O![]() 3ZnO+3H2O+CO2��
3ZnO+3H2O+CO2��
��������
(1)����ɿ�֪����Һ�Ǻ������������п���������п��п�������ᷴӦ���ʼ������п�۵�Ŀ���dz�ȥ���
п�����ᷴӦ��������п����������ѧ����ʽΪ��Zn+H2SO4=ZnSO4+H2����
(2) ��ͼ��֪���������ǹ����Һ�����Ĺ��̣����ڹ��ˣ�
�������ǽ���Һת��Ϊ���壬����������Ũ������
���½ᾧ���Ƶþ���������泥����к��е�Ԫ�أ������������ʻʣ�
����ĥʵ�����г��õ��������в���
(3)�������غ㶨�ɵ�ʵ�ʣ���ѧ��Ӧǰ��Ԫ��������֪�� ����Zn3(OH)4CO3H2O�����������ƣ�������ˮ�Ͷ�����̼����ѧ����ʽΪ
Zn3(OH)4CO3H2O![]() 3ZnO+3H2O+CO2����
3ZnO+3H2O+CO2����