题目内容
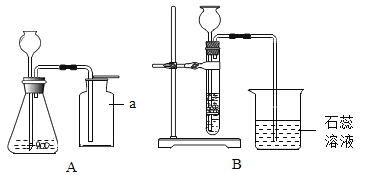
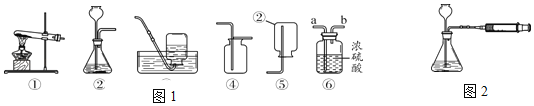
【题目】化学实验小组的同学在用锌粒与下图硫酸溶液(试剂瓶标签部分腐蚀)反应时。发现有气泡产生,并闻列有刺激性气味。他们对此气体的成分进行了探究。
(提出问题)
锌粒加入该硫酸溶液反应生成的气体是什么?
(查阅资料)
①浓硫酸与锌反应,但不产生氢气,也不会产生氧气,能生成二氧化硫气体;
②二氧化硫是一种有刺激性气味,易溶于水,能使品红(一种红色色素)溶液褪色。
(猜想与假设)
甲同学认为:气体可能是H2;乙同学认为:气体可能是SO2;
丙同学认为:气体还可能是_____________。
(实验探究)
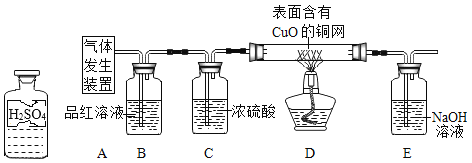
为了验证上述猜想,同学们在老师的指导下设计了如上图的装置(部分夹持器材略去,假设每个能发生的反应都进行完全)进行探究:
实验开始后,观察到B中品红溶液褪色;加热D装置一段时间后,观察到_______ ,证明丙同学的猜想正确。
(反思与交流)
①锌和浓硫酸反应生成硫酸锌、水和二氧化硫,为什么反应过程中又产生了氢气呢?用文字简述原因:___________。
②请写出锌和浓硫酸反应的化学方程式_______________ 。
【答案】H2、SO2 铜网由黑色变红色 随着反应进行,浓硫酸变成稀硫酸,稀硫酸和锌反应生成硫酸锌和氢气 Zn+2H2SO4(浓)=ZnSO4+2H2O+SO2↑
【解析】
[猜想与假设]
甲同学认为:气体可能是H2;乙同学认为:气体可能是SO2;丙同学认为:气体还可能是H2、SO2。
故填:H2、SO2。
[实验探究]
实验开始后,观察到B中品红溶液褪色,说明气体中含有二氧化硫,加热D装置一段时间后,观察到铜网由黑色变红色,说明气体中含有氢气,证明丙同学的猜想正确。
故填:铜网由黑色变红色。
[反思与交流]
①锌和浓硫酸反应生成硫酸锌、水和二氧化硫,反应过程中又产生了氢气的原因:随着反应进行,浓硫酸变成稀硫酸,稀硫酸和锌反应生成硫酸锌和氢气。
故填:随着反应进行,浓硫酸变成稀硫酸,稀硫酸和锌反应生成硫酸锌和氢气。
②锌和浓硫酸反应生成硫酸锌、水和二氧化硫,反应的化学方程式为:Zn+2H2SO4(浓)=ZnSO4+2H2O+SO2↑。
故填:Zn+2H2SO4(浓)=ZnSO4+2H2O+SO2↑。

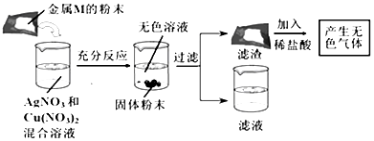
【题目】下表是三种物质在不同温度时的溶解度,根据表中信息回答问题。
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度/g | 氯化钠 | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
硝酸钾 | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 | |
氢氧化钙 | 0.19 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 | |
(1)60℃时,氯化钠的溶解度_______硝酸钾的溶解度(填“>”“=”或“<”)。
(2)20℃时,氯化钠饱和溶液中溶质的质量分数为_______(结果保留至0.1%)。
(3)如图所示,观察到U型管中a的液面低于b的液面,澄清石灰水_____________,则在小试管中加入的物质是_____(填字母)。
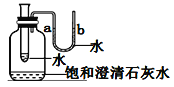
A.浓硫酸 B.氢氧化钠 C.硝酸铵
(4)混有少量氯化钠的硝酸钾固体,加水配成80℃的硝酸钾饱和溶液,再冷却至20℃,析出晶体并得到溶液。下列有关说法中正确的是_______(填字母)。
A.析出的晶体中不一定含有硝酸钾
B.所得溶液一定是硝酸钾饱和溶液
C.上述方法可以将两种物质完全分离