题目内容
 由实验测知:取3.5gKMnO4晶体加热到220°C,分解放出的氧气多于按下式计算的理论量.按下式计算的理论量为放出氧气0.354g,2KMnO4
由实验测知:取3.5gKMnO4晶体加热到220°C,分解放出的氧气多于按下式计算的理论量.按下式计算的理论量为放出氧气0.354g,2KMnO4
| ||
(溶于水呈紫红色) (溶于水呈绿色) (黑色,不溶)
换算成标准状况下的体积为248mL,而实际测得的氧气为308mL(标准状况),超过理论量为:(308-248)m1,=60mL.试回答:
(1)怎样用实验证明:超理论量的氧气不是来自MnO2?
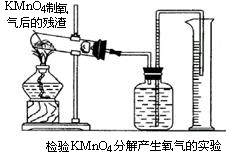
(2)怎样用实验证明超理论量的氧气是由K2MnO4分解产生的?(要求用KMnO4制取氧气后的残渣实验,如图所示.)
(3)怎样从“最后残渣”中分离出MnO2?
分析:(1)只要证明二氧化锰加热后没有氧气生成,就说明超理论量的氧气不是来自二氧化锰.
(2)只要证明锰酸钾加热后有氧气生成,就说明超理论量的氧气是由锰酸钾分解产生的.
(3)可利用二氧化锰和锰酸钾的溶解性不同分离混合物.
(2)只要证明锰酸钾加热后有氧气生成,就说明超理论量的氧气是由锰酸钾分解产生的.
(3)可利用二氧化锰和锰酸钾的溶解性不同分离混合物.
解答:解:(1)氧气能使带火星的木条复燃,应另取少量二氧化锰加热,用带火星的木条检验生成物中是否有氧气.
故答案为:另取少量MnO2,在酒精灯火焰上加热,插入带火星的木条,木条不复燃;
(2)氧气能使带火星的木条复燃,应继续加热残渣,用带火星的木条检验生成物中是否有氧气.
故答案为:用酒精灯火焰集中加热“残渣”,插入带火星的木条,木条复燃;
(3)最后残渣中的二氧化锰不溶于水,其余的都溶于水,应先将混合物加水溶解,使之变成固体和液体的混合物,而分离混合物中的固体和液体一般用过滤的方法.
故答案为:将“最后残渣”加入适量的水溶解,过滤,即可分离出MnO2.
故答案为:另取少量MnO2,在酒精灯火焰上加热,插入带火星的木条,木条不复燃;
(2)氧气能使带火星的木条复燃,应继续加热残渣,用带火星的木条检验生成物中是否有氧气.
故答案为:用酒精灯火焰集中加热“残渣”,插入带火星的木条,木条复燃;
(3)最后残渣中的二氧化锰不溶于水,其余的都溶于水,应先将混合物加水溶解,使之变成固体和液体的混合物,而分离混合物中的固体和液体一般用过滤的方法.
故答案为:将“最后残渣”加入适量的水溶解,过滤,即可分离出MnO2.
点评:本道题主要考查了学生自己动手设计实验的能力,它不是单纯的考查基础知识,而是考查了学生对所学知识的应用能力,让学生要做到“活学活用”.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 图是一瓶浓硫酸标签上的部分内容,某探究小组的同学对这瓶硫酸进行了如下探究,请你参与.
图是一瓶浓硫酸标签上的部分内容,某探究小组的同学对这瓶硫酸进行了如下探究,请你参与.
[查阅资料]浓硫酸有强腐蚀性,溶于水会放热;硫酸钡不溶于水也不溶于酸.
[探究一]浓硫酸稀释时会放热.
(1)稀释浓硫酸时,所需仪器主要有______,应如何稀释浓硫酸?______.测量稀释前后溶液的温度,有明显升高的现象.结论:浓硫酸溶于水放热.
[探究二]稀硫酸与氢氧化钠溶液能发生反应. 图10
| 实验步骤 | 实验现象 | 实验结论 |
| 先用pH试纸测定稀硫酸的pH,再逐滴加入氢氧化钠溶液并不断振荡,同时测混合液的pH | pH逐渐变大, 最后pH≥7 | 稀硫酸与氢氧化钠 溶液能发生反应 |
(3)实验中仅从溶液pH变大,而不强调pH≥7,不能得出稀硫酸与氢氧化钠溶液一定发生反应的结论,理由是______.
[探究三]由于该试剂瓶瓶口密封签已破损,同学们怀疑该浓硫酸的质量分数与标签不相符.
[提出问题]该浓硫酸的质量分数是否发生变化?
[实验探究](4)取该浓硫酸和足量BaCl2溶液反应,过滤、洗涤、干燥沉淀.实验中如何确定硫酸已完全反应______.
(5)为达到实验目的,实验中必须要测知的数据是______.
[探究结论](6)由实验测得的数据计算出的硫酸的质量分数与标签不符.该硫酸的质量分数应______ 98%(填“大于”或“小于”).
 (2009?贵阳)图是一瓶浓硫酸标签上的部分内容,某探究小组的同学对这瓶硫酸进行了如下探究,请你参与.
(2009?贵阳)图是一瓶浓硫酸标签上的部分内容,某探究小组的同学对这瓶硫酸进行了如下探究,请你参与.


 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑