题目内容
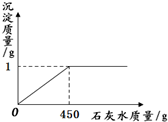 取一定质量的氢氧化钠和碳酸钠混合物完全溶于水中,得到51g溶液,再向溶液中滴加石灰水,产生沉淀的质量与加入石灰水的质量关系如图所示.若氢氧化钠和碳酸钠混合物中钠元素的质量为0.92g.试计算:
取一定质量的氢氧化钠和碳酸钠混合物完全溶于水中,得到51g溶液,再向溶液中滴加石灰水,产生沉淀的质量与加入石灰水的质量关系如图所示.若氢氧化钠和碳酸钠混合物中钠元素的质量为0.92g.试计算:
(1)混合物中氢氧化钠的质量.
(2)恰好反应时,所得溶液中溶质的质量分数.
解:(1)设混合物中碳酸钠的质量为x,生成氢氧化钠的质量为y
Na2CO3+Ca(OH)2═CaCO3↓+2NaOH
106 100 80
x 1 g y
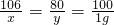
解得:x=1.06g; y=0.8 g
1.06 g碳酸钠中钠元素的质量:
1.06 g×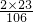 ×100%=0.46 g
×100%=0.46 g
混合物中氢氧化钠的质量:(0.92 g-0.46 g)÷ ×100%=0.8 g
×100%=0.8 g
(2)所得溶液中氢氧化钠的质量分数: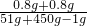 ×100%=0.32%
×100%=0.32%
答:(1)混合物中氢氧化钠的质量为0.8g.
(2)恰好反应时,所得溶液中溶质的质量分数0.32%.
故答案为:
(1)0.8g;
(2)0.32%.
分析:(1)根据图中所示可以知道生成沉淀的质量为1g,即碳酸钙的质量为1g,可以根据化学方程式求算出碳酸钠的质量就,进而计算出其中钠元素的质量,然后就可以求算出氢氧化钠的质量;
(2)恰好反应后的溶液为氢氧化钠的溶液,注意氢氧化钠有两个来源:反应生成的和样品中含有的.
点评:在对反应图象中曲线进行分析时,曲线的折点的意味着曲线所表示的反应在此时恰好完全反应,解答时要理清反应指所发生的反应,并正确的书写化学方程式.
Na2CO3+Ca(OH)2═CaCO3↓+2NaOH
106 100 80
x 1 g y
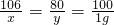
解得:x=1.06g; y=0.8 g
1.06 g碳酸钠中钠元素的质量:
1.06 g×
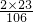 ×100%=0.46 g
×100%=0.46 g混合物中氢氧化钠的质量:(0.92 g-0.46 g)÷
 ×100%=0.8 g
×100%=0.8 g(2)所得溶液中氢氧化钠的质量分数:
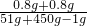 ×100%=0.32%
×100%=0.32%答:(1)混合物中氢氧化钠的质量为0.8g.
(2)恰好反应时,所得溶液中溶质的质量分数0.32%.
故答案为:
(1)0.8g;
(2)0.32%.
分析:(1)根据图中所示可以知道生成沉淀的质量为1g,即碳酸钙的质量为1g,可以根据化学方程式求算出碳酸钠的质量就,进而计算出其中钠元素的质量,然后就可以求算出氢氧化钠的质量;
(2)恰好反应后的溶液为氢氧化钠的溶液,注意氢氧化钠有两个来源:反应生成的和样品中含有的.
点评:在对反应图象中曲线进行分析时,曲线的折点的意味着曲线所表示的反应在此时恰好完全反应,解答时要理清反应指所发生的反应,并正确的书写化学方程式.

练习册系列答案
 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目


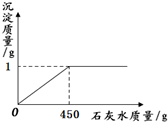 (2010?石景山区一模)取一定质量的氢氧化钠和碳酸钠混合物完全溶于水中,得到51g溶液,再向溶液中滴加石灰水,产生沉淀的质量与加入石灰水的质量关系如图所示.若氢氧化钠和碳酸钠混合物中钠元素的质量为0.92g.试计算:
(2010?石景山区一模)取一定质量的氢氧化钠和碳酸钠混合物完全溶于水中,得到51g溶液,再向溶液中滴加石灰水,产生沉淀的质量与加入石灰水的质量关系如图所示.若氢氧化钠和碳酸钠混合物中钠元素的质量为0.92g.试计算: