题目内容
 请运用“金属活动性顺序”内容及规律等知识解决问题:
请运用“金属活动性顺序”内容及规律等知识解决问题:(1)现在三组物质:①Zn、Cu、稀硫酸;②Zn、Cu、MgSO4溶液;③Zn、Cu、AgNO3溶液,用组内物质就能够比较锌和铜的金属活动性是
B
B
;A.仅有①B.①③C.②③D.①②③
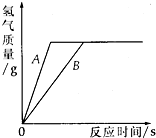
(2)相同质量的铁和锌跟一定量的稀硫酸反应,其反应过程如图所示.试回答:
①曲线A表示的是
锌
锌
(填“铁”或“锌”)跟稀硫酸反应的情况;②该图除能说明①的结论外,还可得出的结论是(填一条)
产生H2的质量相等,说明稀硫酸完全反应
产生H2的质量相等,说明稀硫酸完全反应
;(3)某学校实验室的实验废液中含有大量的FeSO4、CuSO4,小明欲从废液中回收铜和得到硫酸亚铁溶液.他应选用的试剂依次有
过量Fe、适量H2SO4
过量Fe、适量H2SO4
.(实验结束不再产生其他废液)分析:(1)能够和酸溶液反应生成氢气的金属在金属活动性顺序表中应在氢前,在金属活动性顺序表中只有前面的金属可以把排在它后面的金属从它的盐溶液中置换出来.据此分析、比较金属的活动性大小.
(2)①相同质量的铁和锌跟一定量的稀硫酸反应,活泼性强的金属与酸反应所用的时间少;
②根据图象的意义进行分析;
(3)根据金属活动性顺序表的应用和溶液的成分分析加入的试剂.
(2)①相同质量的铁和锌跟一定量的稀硫酸反应,活泼性强的金属与酸反应所用的时间少;
②根据图象的意义进行分析;
(3)根据金属活动性顺序表的应用和溶液的成分分析加入的试剂.
解答:解:(1)在①中由于锌可以和稀硫酸反应而铜不能和稀硫酸反应,因此可以说明锌的金属活动性比铜强,而在②中锌和铜都不能和硫酸镁溶液反应,因此不能分辨出锌和铜的金属活动性顺序,在③中锌可以和CuCl2溶液反应,说明锌的金属活动性比铜强.所以,B正确;
(2)①根据图示可知,在它们停止反应时,金属A所利用的时间比金属B的少(即金属A的反应速度比金属B的快),说明金属A的活动性大于金属B,又因锌的活动性比铁强,所以金属A为锌;
②由图象可知,图示曲线上待反应停止后,所得氢气质量相等,说明稀硫酸完全反应.
(3)要除去硫酸铜,得到硫酸亚铁,可以使用过量的铁与硫酸铜反应,多余的铁与适量稀硫酸反应,得到硫酸亚铁溶液.
故答为:(1)B; (2)①锌; ②产生H2的质量相等,说明稀硫酸完全反应;(3)过量Fe、适量H2SO4.
(2)①根据图示可知,在它们停止反应时,金属A所利用的时间比金属B的少(即金属A的反应速度比金属B的快),说明金属A的活动性大于金属B,又因锌的活动性比铁强,所以金属A为锌;
②由图象可知,图示曲线上待反应停止后,所得氢气质量相等,说明稀硫酸完全反应.
(3)要除去硫酸铜,得到硫酸亚铁,可以使用过量的铁与硫酸铜反应,多余的铁与适量稀硫酸反应,得到硫酸亚铁溶液.
故答为:(1)B; (2)①锌; ②产生H2的质量相等,说明稀硫酸完全反应;(3)过量Fe、适量H2SO4.
点评:主要考查了金属的活动性顺序,并能根据反应来判断金属的活动性强弱,培养学生解决问题的能力.

练习册系列答案
相关题目
运用金属活动性顺序能帮助我们设计实验比较金属的活动性强弱.为了比较铝和铜的活动性强弱小丽同学设计了下列三个实验:
我发现只需完成其中的______(填实验编号)实验就能达到实验目的,请写出所选实验中发生反应的化学方程式______.
| 实验编号 | 实验设计 |
| A | 将铝丝放入装有少量稀盐酸的试管中 |
| B | 将铜丝放入装有少量稀盐酸的试管中 |
| C | 将铝丝放入装有2Ml10%的硫酸铜溶液的试管中 |
 请运用“金属活动性顺序”内容及规律等知识解决问题:
请运用“金属活动性顺序”内容及规律等知识解决问题: