题目内容
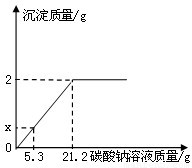
 某盐场生产的食盐产品中含有氯化钙杂质.某化学兴趣小组为测定该食品产品中氯化钠的质量分数,进行了如下实验:取100 g食盐样品完全溶解于水,逐滴加入碳酸钠溶液,反应关系如图所示:
某盐场生产的食盐产品中含有氯化钙杂质.某化学兴趣小组为测定该食品产品中氯化钠的质量分数,进行了如下实验:取100 g食盐样品完全溶解于水,逐滴加入碳酸钠溶液,反应关系如图所示:(1)发生反应的化学方程式为
(2)图中x=
(3)求该食盐产品中氯化钠的质量分数?为
分析:由图象可知,当生成沉淀的质量为2克时,食盐中的氯化钙恰好完全反应,根据此时沉淀的质量可求得氯化钙的质量.根据消耗的碳酸钠溶液质量与生成沉淀的质量成正比例关系,可求加入5.3克碳酸钠溶液时所生成沉淀的质量.
解答:解:(1)氯化钠与碳酸钠不反应,所以发生反应的方程式为CaCl2+Na2CO3═CaCO3↓+2NaCl.
(2)当生成2克沉淀时,消耗碳酸钠溶液21.2克,按比例关系,则有
=
,X=0.5克
(3)设食盐产品中氯化钙的质量为y,则
CaCl2+Na2CO3═CaCO3↓+2NaCl
111 100
y 2克
=
,y=2.22克
100克-2.22克=97.78克,
×100%=97.8%.
答:该食盐产品中氯化钠的质量分数97.8%
故答案为:(1)CaCl2+Na2CO3═CaCO3↓+2NaCl; (2)0.5; (3)97.8%.
(2)当生成2克沉淀时,消耗碳酸钠溶液21.2克,按比例关系,则有
| 21.2克 |
| 5.3克 |
| 2克 |
| X |
(3)设食盐产品中氯化钙的质量为y,则
CaCl2+Na2CO3═CaCO3↓+2NaCl
111 100
y 2克
| 111 |
| 100 |
| y |
| 2克 |
100克-2.22克=97.78克,
| 97.78克 |
| 100克 |
答:该食盐产品中氯化钠的质量分数97.8%
故答案为:(1)CaCl2+Na2CO3═CaCO3↓+2NaCl; (2)0.5; (3)97.8%.
点评:对于带有图象或图表的计算题,在近年的中考中出现频度较高,能对图象或图表进行分析得出所需信息是解题的关键.

练习册系列答案
 特高级教师点拨系列答案
特高级教师点拨系列答案
相关题目
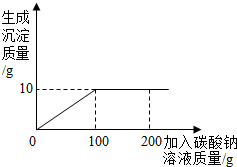 (2012?犍为县二模)某盐场生产的食盐产品中含有氯化钙杂质.某化学兴趣小组为测定该食盐产品中氯化钠的含量,进行了如下实验:取13.4g固体样品,全部溶于96.6g水中,向所得的混合溶液中逐滴加入碳酸钠溶液,反应关系如图所示.
(2012?犍为县二模)某盐场生产的食盐产品中含有氯化钙杂质.某化学兴趣小组为测定该食盐产品中氯化钠的含量,进行了如下实验:取13.4g固体样品,全部溶于96.6g水中,向所得的混合溶液中逐滴加入碳酸钠溶液,反应关系如图所示. 某盐场生产的食盐产品中含有氯化钙杂质.某化学兴趣小组为测定该食盐产品中氯化钠的含量,进行了如下实验:取13.4g固体样品,全部溶于96.6g水中,向所得的混合溶液中逐滴加入碳酸钠溶液,反应关系如图所示.
某盐场生产的食盐产品中含有氯化钙杂质.某化学兴趣小组为测定该食盐产品中氯化钠的含量,进行了如下实验:取13.4g固体样品,全部溶于96.6g水中,向所得的混合溶液中逐滴加入碳酸钠溶液,反应关系如图所示.