题目内容
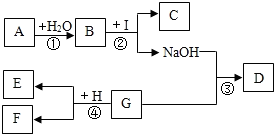 A-I为初中化学中常见的物质.已知A为金属氧化物,C为大理石的主要成分,D为蓝色沉淀,G、I均为只含有一种溶质的溶液.“→”表示物质间存在着相互转化的关系(部分生成物未标出),如图所示.请回答下列问题:
A-I为初中化学中常见的物质.已知A为金属氧化物,C为大理石的主要成分,D为蓝色沉淀,G、I均为只含有一种溶质的溶液.“→”表示物质间存在着相互转化的关系(部分生成物未标出),如图所示.请回答下列问题:
(1)写出化学式:A______,D______.
(2)写出B与I反应的化学方程式:______.反应①、②、③、④中属于复分解反应的为______(填序号).
(3)已知H为铁粉,与溶液G充分反应后过滤.向滤渣E中加入稀盐酸,有无色气体放出,则滤渣E中一定含有______,滤液F中一定含有的金属阳离子是______.
解:(1)C为大理石的主要成分,所以C为碳酸钙,根据B与I反应能生成碳酸钙和氢氧化钠,是B与I交换成分生成的碳酸钙和氢氧化钠,所以将碳酸钙和氢氧化钠相互交换成分为:碳酸钠和氢氧化钙,属于B与I两种物质中的成分,A为金属氧化物,A与水反应生成B,所以B是碱溶液,即氢氧化钙,所以A是氧化钙;I是碳酸钠,D为蓝色沉淀是氢氧化铜;
(2)B与I反应的反应物是氢氧化钙和碳酸钠,生成物是碳酸钙沉淀和氢氧化钠,用观察法配平,碳酸钙后面标上沉淀符号;反应①是氧化钙与水反应生成氢氧化钙是分解反应,反应②是
Ca(OH)2+Na2CO3═CaCO3↓+2NaOH符合复分解反应的特征,反应③是氢氧化钠和铜的盐溶液反应,符合复分解反应的特征,反应④是金属与盐溶液的反应,是置换反应;
(3)由于G和氢氧化钠反应生成氢氧化铜沉淀,所以G为铜盐的溶液,铁和铜盐反应能生成亚铁盐和铜,向滤渣E中加入稀盐酸,有无色气体放出,说明有排在氢前面的金属剩余,即铁有剩余,则铁会把排在它后面的铜全部置换出来,这时滤渣成分是铁、铜,所以溶液F中一定存在的金属阳离子是亚铁离子.
故答案为:(1)CaO;Cu(OH)2;
(2)Ca(OH)2+Na2CO3═CaCO3↓+2NaOH;②③;
(3)Cu、Fe;Fe2+.
分析:找出解答本题的突破口:C为大理石的主要成分,所以C为碳酸钙,根据B与I反应能生成碳酸钙和氢氧化钠,来反推出B和I,还需结合A为金属氧化物,A与水反应生成B,确定出B和I的具体物质,向滤渣E中加入稀盐酸,有无色气体放出,说明有排在氢前面的金属,再进一步进行分析即可.
点评:本题为推断题,做这类题目关键是从题干中根据所学知识找出题眼-----突破口,然后顺藤摸瓜理出各物质之间的反应,并判断出各物质.
(2)B与I反应的反应物是氢氧化钙和碳酸钠,生成物是碳酸钙沉淀和氢氧化钠,用观察法配平,碳酸钙后面标上沉淀符号;反应①是氧化钙与水反应生成氢氧化钙是分解反应,反应②是
Ca(OH)2+Na2CO3═CaCO3↓+2NaOH符合复分解反应的特征,反应③是氢氧化钠和铜的盐溶液反应,符合复分解反应的特征,反应④是金属与盐溶液的反应,是置换反应;
(3)由于G和氢氧化钠反应生成氢氧化铜沉淀,所以G为铜盐的溶液,铁和铜盐反应能生成亚铁盐和铜,向滤渣E中加入稀盐酸,有无色气体放出,说明有排在氢前面的金属剩余,即铁有剩余,则铁会把排在它后面的铜全部置换出来,这时滤渣成分是铁、铜,所以溶液F中一定存在的金属阳离子是亚铁离子.
故答案为:(1)CaO;Cu(OH)2;
(2)Ca(OH)2+Na2CO3═CaCO3↓+2NaOH;②③;
(3)Cu、Fe;Fe2+.
分析:找出解答本题的突破口:C为大理石的主要成分,所以C为碳酸钙,根据B与I反应能生成碳酸钙和氢氧化钠,来反推出B和I,还需结合A为金属氧化物,A与水反应生成B,确定出B和I的具体物质,向滤渣E中加入稀盐酸,有无色气体放出,说明有排在氢前面的金属,再进一步进行分析即可.
点评:本题为推断题,做这类题目关键是从题干中根据所学知识找出题眼-----突破口,然后顺藤摸瓜理出各物质之间的反应,并判断出各物质.

练习册系列答案
相关题目

