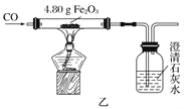
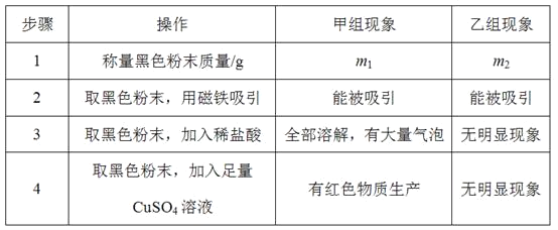
题目内容
【题目】将20.0g稀盐酸逐滴加入到10.0g溶质质量分数为4.0%的氢氧化钠溶液中,边滴加边搅拌,随着稀盐酸的滴加,溶液的pH变化情况如图所示,溶液的温度变化如表所示(不考虑反应过程中热量散失)
反应时间(s) | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
溶液温度(℃) | 20.5 | 20.6 | 20.7 | 20.8 | 20.9 | 20.8 | 20.7 |
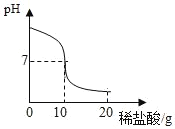
(1)当稀盐酸与氢氧化钠溶液恰好完全反应时,溶液的温度是_____℃
(2)计算稀盐酸中溶质的质量分数_____(精确到0.1%)
【答案】20.9 3.7%
【解析】
(1)由表格可看出,刚开始随着反应的进行溶液的温度逐渐升高,这说明酸碱中和是放热反应,酸碱恰好完全反应时放出的热量最多,此时溶液的温度最高。当稀盐酸与氢氧化钠溶液恰好完全反应时,溶液的温度是20.9℃
(2)酸碱恰好完全反应时,溶液的pH等于7,此时盐酸溶液的质量为10g。氢氧化钠的质量=10.0g×4.0%=0.4g
设:盐酸溶液的溶质的质量分数为x
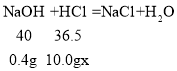
![]() x=3.7%
x=3.7%
答:(1)20.9
(2)稀盐酸中溶质的质量分数为3.7%

练习册系列答案
相关题目