题目内容
某工厂的甲、乙、丙三个车间排出的污水中分别含有以下六种物质中的两种:KOH、HNO3、AgNO3、KCl、K2SO4、Ba(NO3)2.三个车间的污水经过滤后初步分析,情况如下:
| 溶液 | 外观 | pH | 溶液成分 | |
| 甲 | 无色、透明 | >7 | ? | ? |
| 乙 | 无色、透明 | =7 | Ba(NO3)2 | ? |
| 丙 | 无色、透明 | <7 | ? | ? |
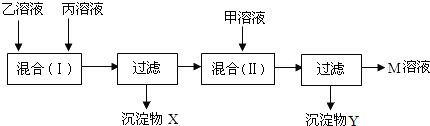
已知溶液中不可能同时存在Ag+和OH-,且两次混合均完全反应.根据以上信息回答:
(1)甲溶液中肯定含有的物质是(填化学式,下同)______,可能含有的另一种物质是______,据此,沉淀X是______.
(2)根据(1)的判断,混合(Ⅱ)发生反应的化学方程式是______;
(3)M溶液中溶质的化学式是______,它是一种复合肥料,含有农作物所需的营养元素是(填元素符号)______.
解:(1)因甲的PH>7,上述六种物质只有KOH为碱,则一定有KOH;已知溶液中不可能同时存在Ag+和OH-,则甲中不会有AgNO3,又乙中一定有Ba(NO3)2,丙中的PH<7,则丙中一定含有HNO3,根据物质的共存可知甲中可能有K2SO4或KCl,则乙和丙混合时得到X沉淀的成分有两种情况,①若甲中有KOH和K2SO4,则乙和丙混合生成AgCl沉淀;②若甲中有KOH和KCl,则乙和丙混合生成BaSO4沉淀;
故答案为:KOH,K2SO4(或KCl),AgCl(或BaSO4).
(2)若甲中有KOH和K2SO4,则乙和丙混合生成AgCl沉淀后的滤液中主要有Ba(NO3)2和HNO3,则发生的反应为:
K2SO4+Ba(NO3)2═BaSO4↓+2KNO3;HNO3+KOH═H2O+KNO3;
若甲中有KOH和KCl,则乙和丙混合生成硫酸钡沉淀后滤液中主要有HNO3和AgNO3,则发生的反应为:
KCl+AgNO3═AgCl↓+KNO3;HNO3+KOH═H2O+KNO3;
故答案为:K2SO4+Ba(NO3)2═BaSO4↓+2KNO3;HNO3+KOH═H2O+KNO3或KCl+AgNO3═AgCl↓+KNO3;HNO3+KOH═H2O+KNO3;
(3)因六种物质两次混合均完全反应,混合时生成硫酸钡和氯化银沉淀及水,而钾盐和硝酸盐都能溶于水,则两次混合后M溶液中的溶质为KNO3,其中的K、N是植物生长的营养元素,故答案为:KNO3;K、N.
分析:(1)根据污水分析情况和溶液的PH来分析一定有的物质,并根据离子的共存来判断可能有的物质;
(2)根据其可能的成分来书写对应的化学反应方程式;
(3)将六种物质中的离子混合后,利用只有K+和NO3-存在,其余离子转化为沉淀或水来解答.
点评:本题较难,考查利用信息及复分解反应发生的条件来处理工厂污水问题,学生应学会结合所学知识并灵活应用知识来解决实际问题,还要注意考虑问题要全面,比如本题三个厂污水中可能含的物质有几种可能性,针对不同情况发生的反应是不同的.
故答案为:KOH,K2SO4(或KCl),AgCl(或BaSO4).
(2)若甲中有KOH和K2SO4,则乙和丙混合生成AgCl沉淀后的滤液中主要有Ba(NO3)2和HNO3,则发生的反应为:
K2SO4+Ba(NO3)2═BaSO4↓+2KNO3;HNO3+KOH═H2O+KNO3;
若甲中有KOH和KCl,则乙和丙混合生成硫酸钡沉淀后滤液中主要有HNO3和AgNO3,则发生的反应为:
KCl+AgNO3═AgCl↓+KNO3;HNO3+KOH═H2O+KNO3;
故答案为:K2SO4+Ba(NO3)2═BaSO4↓+2KNO3;HNO3+KOH═H2O+KNO3或KCl+AgNO3═AgCl↓+KNO3;HNO3+KOH═H2O+KNO3;
(3)因六种物质两次混合均完全反应,混合时生成硫酸钡和氯化银沉淀及水,而钾盐和硝酸盐都能溶于水,则两次混合后M溶液中的溶质为KNO3,其中的K、N是植物生长的营养元素,故答案为:KNO3;K、N.
分析:(1)根据污水分析情况和溶液的PH来分析一定有的物质,并根据离子的共存来判断可能有的物质;
(2)根据其可能的成分来书写对应的化学反应方程式;
(3)将六种物质中的离子混合后,利用只有K+和NO3-存在,其余离子转化为沉淀或水来解答.
点评:本题较难,考查利用信息及复分解反应发生的条件来处理工厂污水问题,学生应学会结合所学知识并灵活应用知识来解决实际问题,还要注意考虑问题要全面,比如本题三个厂污水中可能含的物质有几种可能性,针对不同情况发生的反应是不同的.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
某工厂的甲、乙、丙三个车间排出的污水中分别含有以下六种物质中的两种:KOH、HNO3、AgNO3、KCl、K2SO4、Ba(NO3)2。三个车间的污水经过滤后初步分析,情况如下:
| 车间 | 外观 | pH | 污水成分 | |
| 肯定含有 | 可能含有 | |||
| 甲 | 无色、透明 | >7 | ? | ? |
| 乙 | 无色、透明 | =7 | Ba(NO3)2 | ? |
| 丙 | 无色、透明 | <7 | ? | ? |
为了进一步确定各溶液的组成,进行如下实验:
 |
已知溶液中不可能同时存在Ag+和OH-,且两次混合均完全反应。根据以上信息回答:
(1)甲溶液中肯定含有的物质是(填化学式,下同) ,可能含有的另一种物质是 ,据此,沉淀X是 。
(2)根据(1)的判断,混合(Ⅱ)发生反应的化学方程式是 ;
(3)M溶液中溶质的化学式是 ,它是一种复合肥料,含有农作物所需的营养元素是(填元素符号) 。
某工厂的甲、乙、丙三个车间排出的污水中分别含有以下六种物质中的两种:KOH、HNO3、AgNO3、KCl、K2SO4、Ba(NO3)2.三个车间的污水经过滤后初步分析,情况如下:
为了进一步确定各溶液的组成,进行如下实验:
已知溶液中不可能同时存在Ag+和OH-,且两次混合均完全反应.根据以上信息回答:
(1)甲溶液中肯定含有的物质是(填化学式,下同)______,可能含有的另一种物质是______,据此,沉淀X是______.
(2)根据(1)的判断,混合(Ⅱ)发生反应的化学方程式是______;
(3)M溶液中溶质的化学式是______,它是一种复合肥料,含有农作物所需的营养元素是(填元素符号)______.
| 溶液 | 外观 | pH | 溶液成分 | |
| 甲 | 无色、透明 | >7 | ? | ? |
| 乙 | 无色、透明 | =7 | Ba(NO3)2 | ? |
| 丙 | 无色、透明 | <7 | ? | ? |

已知溶液中不可能同时存在Ag+和OH-,且两次混合均完全反应.根据以上信息回答:
(1)甲溶液中肯定含有的物质是(填化学式,下同)______,可能含有的另一种物质是______,据此,沉淀X是______.
(2)根据(1)的判断,混合(Ⅱ)发生反应的化学方程式是______;
(3)M溶液中溶质的化学式是______,它是一种复合肥料,含有农作物所需的营养元素是(填元素符号)______.
(2007?广州)某工厂的甲、乙、丙三个车间排出的污水中分别含有以下六种物质中的两种:KOH、HNO3、AgNO3、KCl、K2SO4、Ba(NO3)2.三个车间的污水经过滤后初步分析,情况如下:
为了进一步确定各溶液的组成,进行如下实验:
已知溶液中不可能同时存在Ag+和OH-,且两次混合均完全反应.根据以上信息回答:
(1)甲溶液中肯定含有的物质是(填化学式,下同)______,可能含有的另一种物质是______,据此,沉淀X是______.
(2)根据(1)的判断,混合(Ⅱ)发生反应的化学方程式是______;
(3)M溶液中溶质的化学式是______,它是一种复合肥料,含有农作物所需的营养元素是(填元素符号)______.
| 溶液 | 外观 | pH | 溶液成分 | |
| 甲 | 无色、透明 | >7 | ? | ? |
| 乙 | 无色、透明 | =7 | Ba(NO3)2 | ? |
| 丙 | 无色、透明 | <7 | ? | ? |

已知溶液中不可能同时存在Ag+和OH-,且两次混合均完全反应.根据以上信息回答:
(1)甲溶液中肯定含有的物质是(填化学式,下同)______,可能含有的另一种物质是______,据此,沉淀X是______.
(2)根据(1)的判断,混合(Ⅱ)发生反应的化学方程式是______;
(3)M溶液中溶质的化学式是______,它是一种复合肥料,含有农作物所需的营养元素是(填元素符号)______.
