题目内容
将10g一氧化碳和二氧化碳的气体通入足量的澄清石灰水中,充分反应后,过滤,得到10g沉淀.求:①CO2的相对分子质量为______;
②原混合气体中二氧化碳的质量分数.(写出必要的计算过程)
【答案】分析:①根据化学式进行计算;
②根据二氧化碳与氢氧化钙反应的方程式,由碳酸钙的质量求出二氧化碳的质量,再求出原混合气体中二氧化碳的质量分数.
解答:解:①CO2的相对分子质量为:12+16×2=44;
②原混合气体中二氧化碳的质量为x
CO2+Ca(OH)2=CaCO3↓+H2O
44 100
x 10g
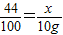 解得:x=4.4g
解得:x=4.4g
原混合气体中二氧化碳的质量分为: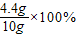 =44%
=44%
故答为:①44;
②原混合气体中二氧化碳的质量分数是44%.
点评:本题主要考查了化学式、化学方程式的基本计算,难度不大,注意解题格式要规范,解题的数据要准确.
②根据二氧化碳与氢氧化钙反应的方程式,由碳酸钙的质量求出二氧化碳的质量,再求出原混合气体中二氧化碳的质量分数.
解答:解:①CO2的相对分子质量为:12+16×2=44;
②原混合气体中二氧化碳的质量为x
CO2+Ca(OH)2=CaCO3↓+H2O
44 100
x 10g
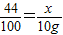 解得:x=4.4g
解得:x=4.4g原混合气体中二氧化碳的质量分为:
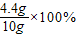 =44%
=44%故答为:①44;
②原混合气体中二氧化碳的质量分数是44%.
点评:本题主要考查了化学式、化学方程式的基本计算,难度不大,注意解题格式要规范,解题的数据要准确.

练习册系列答案
相关题目
联合钢铁工业的基本生产流程示意图如下,请回答相关问题.

(1)上述3种含铁物质中,属于金属材料的是: ;
(2)铁在氧气中燃烧的化学方程式为:
(3)某同学取赤铁矿样品10g,与足量的一氧化碳充分反应,并将生成的气体通入足量的氢氧化钠的溶液中,溶液的质量增加了5.5g.请你根据该同学的实验数据,计算出赤铁矿样品中三氧化二铁的质量分数.
(4)铁制品使用过程中会生锈,情况调查如下:
从调查中可知铁制品生锈的主要条件是 ;工业上常用稀盐酸除去铁锈,反应的化学方程式为: ;下列保护铁资源的建议中,正确的是 .(填字母)
A.防止铁制品腐蚀 B.回收利用废旧铁制品 C.任意开采铁矿石
(5)锰和铁在周期表中位置、相对原子质量(锰是55,铁是56)相近.锰与铁的金属活动性谁更强呢?
实验设计:相同温度下,取大小相同的两种金属薄片,用砂纸将表面擦光亮,分别投入等体积、等浓度且足量的稀盐酸中反应,观察现象,填写结论.
除了比较与酸反应产生气体速度的快慢,你还有其他化学方法可比较这二种金属活动性的强弱吗?请举出一种方法(写出原理即可) .

(1)上述3种含铁物质中,属于金属材料的是:
(2)铁在氧气中燃烧的化学方程式为:
(3)某同学取赤铁矿样品10g,与足量的一氧化碳充分反应,并将生成的气体通入足量的氢氧化钠的溶液中,溶液的质量增加了5.5g.请你根据该同学的实验数据,计算出赤铁矿样品中三氧化二铁的质量分数.
(4)铁制品使用过程中会生锈,情况调查如下:
| 调查内容 | 掉漆的自行车 | 裸露在混凝土 以外的钢筋 |
涂油的 无锈铁钉 |
镀铬铁质剪刀 |
| 铁制品锈蚀 的现象 |
风吹雨淋,时间长了,掉漆的部分会生锈 | 时间长了钢筋表面出现锈层 | 铁钉较长时间仍不生锈 | 剪刀较长时间不生锈 |
A.防止铁制品腐蚀 B.回收利用废旧铁制品 C.任意开采铁矿石
(5)锰和铁在周期表中位置、相对原子质量(锰是55,铁是56)相近.锰与铁的金属活动性谁更强呢?
实验设计:相同温度下,取大小相同的两种金属薄片,用砂纸将表面擦光亮,分别投入等体积、等浓度且足量的稀盐酸中反应,观察现象,填写结论.
| 金属 | 铁 | 锰 |
| 与盐酸反应现象 | 放出气泡速度缓慢 | 放出气泡速度较快 |
| 结论 | ||
2011年是国际化学年(IYC2011),其宗旨是“增进公众对化学重要性的认识,鼓励青年人热爱化学,学习和研究化学”.某校化学兴趣小组的同学,对课本中一氧化碳还原氧化铁实验作了绿色化改进后制取单质铁(K1,K2是活塞):
(1)关闭K1、开启K2,可以验证CO还原Fe2O3的产物.

①这是关于气体的实验,实验前必须对装置进行装置的气密性检查;
②CO还原Fe2O3的化学方程式为 ;
③在f处点燃气体的目的是 .
(2)关闭K2,开启K1,可以将e口出来的气体再从a通入装置而循环使用.
①d瓶中应装 (填序号).
A.澄清石灰水 B.水 C.石蕊溶液 D.浓硫酸
②该实验这样改进的主要优点是 .
(3)小刚用一种不纯的氧化铁粉末样品(杂质为铁粉),通过该实验测定样品中氧化铁的质量分数.
小刚称取10g样品,利用上图所示装置进行实验,相关实验数据见下表:(玻璃管内的物质完全反应)
①由上表数据可分析出,反应后硬质玻璃管及所盛固体总质量减少的是 的质量.
②请依据c装置总质量变化的数据,计算出样品中氧化铁的质量分数(写出计算过程).
解:设样品中氧化铁的质量为x
.
(1)关闭K1、开启K2,可以验证CO还原Fe2O3的产物.

①这是关于气体的实验,实验前必须对装置进行装置的气密性检查;
②CO还原Fe2O3的化学方程式为 ;
③在f处点燃气体的目的是 .
(2)关闭K2,开启K1,可以将e口出来的气体再从a通入装置而循环使用.
①d瓶中应装 (填序号).
A.澄清石灰水 B.水 C.石蕊溶液 D.浓硫酸
②该实验这样改进的主要优点是 .
(3)小刚用一种不纯的氧化铁粉末样品(杂质为铁粉),通过该实验测定样品中氧化铁的质量分数.
小刚称取10g样品,利用上图所示装置进行实验,相关实验数据见下表:(玻璃管内的物质完全反应)
| 编号 | 称量物 | 反应前 | 反映后 |
| 一 | 硬质玻璃管及所盛固体总质量 | 76.2g | 73.8g |
| 二 | C装置总质量 | 153.7g | 160.3g |
②请依据c装置总质量变化的数据,计算出样品中氧化铁的质量分数(写出计算过程).
解:设样品中氧化铁的质量为x
.

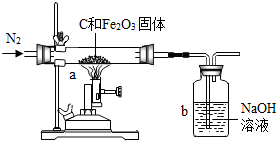 (2012?鼓楼区一模)化学兴趣小组的同学为了测定某赤铁矿石中氧化铁的质量分数.
(2012?鼓楼区一模)化学兴趣小组的同学为了测定某赤铁矿石中氧化铁的质量分数.

