题目内容
某兴趣小组对一根生锈铁丝进行探究.其成分中含有Fe、Fe2O3.
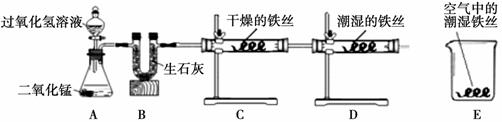
(1)将除锈后光亮的铁丝同时分别放置在下列三种环境中,然后观察、研究.
A.密封在干燥的空气中 B.放置在潮湿的空气中 C.浸没在煮沸后的蒸馏水中
①铁丝在上述三种环境中放置一段时间后,最有明显铁锈生成的是
②为防止金属锈蚀,请你写出一种防止锈蚀的方法
(2)兴趣小组的同学称取一根生锈铁丝于一烧杯中,加适量的稀硫酸,恰好完全反应.已知,除了Fe、Fe2O3分别能与稀硫酸反应外,还发生反应:Fe+Fe2(SO4)3=3FeSO4
①从化学元素与人体健康的角度考虑,我们应选用铁锅而不是铝锅.为什么?
②该反应过程中,观察到的明显反应现象是(答一条即可)
③向上述盛有反应后溶液的烧杯中滴入200g质量分数为10.4%的氯化钡溶液,恰好完全反应,通过计算,求此时所得不饱和溶液中溶质的质量.(计算结果精确到0.1g)
(1)将除锈后光亮的铁丝同时分别放置在下列三种环境中,然后观察、研究.
A.密封在干燥的空气中 B.放置在潮湿的空气中 C.浸没在煮沸后的蒸馏水中
①铁丝在上述三种环境中放置一段时间后,最有明显铁锈生成的是
B
B
(填序号).②为防止金属锈蚀,请你写出一种防止锈蚀的方法
保持铁制品表面干燥与洁净等
保持铁制品表面干燥与洁净等
.(2)兴趣小组的同学称取一根生锈铁丝于一烧杯中,加适量的稀硫酸,恰好完全反应.已知,除了Fe、Fe2O3分别能与稀硫酸反应外,还发生反应:Fe+Fe2(SO4)3=3FeSO4
①从化学元素与人体健康的角度考虑,我们应选用铁锅而不是铝锅.为什么?
铁元素是人体必须的微量元素,铝元素不是,而且铝元素的过量摄入对人体有害
铁元素是人体必须的微量元素,铝元素不是,而且铝元素的过量摄入对人体有害
②该反应过程中,观察到的明显反应现象是(答一条即可)
固体逐渐溶解,溶液先由无色变黄色,后由黄色逐渐变为浅绿色等
固体逐渐溶解,溶液先由无色变黄色,后由黄色逐渐变为浅绿色等
③向上述盛有反应后溶液的烧杯中滴入200g质量分数为10.4%的氯化钡溶液,恰好完全反应,通过计算,求此时所得不饱和溶液中溶质的质量.(计算结果精确到0.1g)
分析:(1)①铁在空气中锈蚀,实际上是铁跟空气中的氧气和水共同作用的结果,据此进行分析判断.
②铁与水、氧气充分接触时容易生锈,使铁制品与氧气和水隔绝可以防止生锈.
(2)①根据铝元素是对人体有害的元素,而铁是人体必需的微量元素,据此进行分析解答.
②铁锈的主要成分氧化铁能与稀硫酸反应生成硫酸铁和水,铁与稀硫酸反应生成硫酸亚铁和氢气,由题意还发生反应:Fe+Fe2(SO4)3=3FeSO4,据此进行分析解答.
③反应后溶液为硫酸亚铁溶液,滴入200g质量分数为10.4%的氯化钡溶液,恰好完全反应,硫酸亚铁与氯化钡溶液反应生成硫酸钡沉淀和氯化亚铁溶液,据此由200g质量分数为10.4%的氯化钡溶液,由反应的化学方程式计算出此时所得不饱和溶液中溶质的质量即可.
②铁与水、氧气充分接触时容易生锈,使铁制品与氧气和水隔绝可以防止生锈.
(2)①根据铝元素是对人体有害的元素,而铁是人体必需的微量元素,据此进行分析解答.
②铁锈的主要成分氧化铁能与稀硫酸反应生成硫酸铁和水,铁与稀硫酸反应生成硫酸亚铁和氢气,由题意还发生反应:Fe+Fe2(SO4)3=3FeSO4,据此进行分析解答.
③反应后溶液为硫酸亚铁溶液,滴入200g质量分数为10.4%的氯化钡溶液,恰好完全反应,硫酸亚铁与氯化钡溶液反应生成硫酸钡沉淀和氯化亚铁溶液,据此由200g质量分数为10.4%的氯化钡溶液,由反应的化学方程式计算出此时所得不饱和溶液中溶质的质量即可.
解答:解:(1)①A.铁丝密封在干燥的空气中,不易与氧气、水分接触,不易生锈.
B.铁丝放置在潮湿的空气中,能与氧气、水分充分接触,容易生锈.
C.铁丝浸没在煮沸后的蒸馏水中,只能与水分接触,不易生锈.
②为了防止钢铁的锈蚀,人们常采用保持铁制品表面干燥与洁净、在其表面刷油漆或镀上其他金属等覆盖保护膜的方法,这些方法都能够防止锈蚀的共同原理是隔绝氧气和水.
(2)①铁是人体必需的微量元素,而铝是非必需元素,而且铝元素的过量摄入对人体有害,从化学元素与人体健康的角度考虑,我们应选用铁锅.
②铁锈的主要成分氧化铁能与稀硫酸反应生成硫酸铁和水,铁与稀硫酸反应生成硫酸亚铁和氢气,故或观察到固体逐渐溶解,溶液由无色变黄色;由题意还发生反应:Fe+Fe2(SO4)3=3FeSO4,生成的硫酸亚铁溶液显浅绿色,故然后会观察到由黄色逐渐变为浅绿色.
③200g质量分数为10.4%的氯化钡溶液中含氯化钡的质量为200g×10.4%=20.8g,
设生成的氯化亚铁的质量的为x
FeSO4+BaCl2═BaSO4↓+FeCl2
208 127
20.8g x
=
x=12.7g
故答案为:(1)①B;②保持铁制品表面干燥与洁净等;
(2)①铁元素是人体必须的微量元素,铝元素不是,而且铝元素的过量摄入对人体有害.②固体逐渐溶解,溶液先由无色变黄色,后由黄色逐渐变为浅绿色;③此时所得不饱和溶液中溶质的质量12.7g.
B.铁丝放置在潮湿的空气中,能与氧气、水分充分接触,容易生锈.
C.铁丝浸没在煮沸后的蒸馏水中,只能与水分接触,不易生锈.
②为了防止钢铁的锈蚀,人们常采用保持铁制品表面干燥与洁净、在其表面刷油漆或镀上其他金属等覆盖保护膜的方法,这些方法都能够防止锈蚀的共同原理是隔绝氧气和水.
(2)①铁是人体必需的微量元素,而铝是非必需元素,而且铝元素的过量摄入对人体有害,从化学元素与人体健康的角度考虑,我们应选用铁锅.
②铁锈的主要成分氧化铁能与稀硫酸反应生成硫酸铁和水,铁与稀硫酸反应生成硫酸亚铁和氢气,故或观察到固体逐渐溶解,溶液由无色变黄色;由题意还发生反应:Fe+Fe2(SO4)3=3FeSO4,生成的硫酸亚铁溶液显浅绿色,故然后会观察到由黄色逐渐变为浅绿色.
③200g质量分数为10.4%的氯化钡溶液中含氯化钡的质量为200g×10.4%=20.8g,
设生成的氯化亚铁的质量的为x
FeSO4+BaCl2═BaSO4↓+FeCl2
208 127
20.8g x
| 208 |
| 127 |
| 20.8g |
| x |
故答案为:(1)①B;②保持铁制品表面干燥与洁净等;
(2)①铁元素是人体必须的微量元素,铝元素不是,而且铝元素的过量摄入对人体有害.②固体逐渐溶解,溶液先由无色变黄色,后由黄色逐渐变为浅绿色;③此时所得不饱和溶液中溶质的质量12.7g.
点评:本题难度不大,掌握铁锈蚀的条件与防止锈蚀的措施、利用化学方程式与溶质质量分数的综合计算是正确解答本题的关键.

练习册系列答案
相关题目

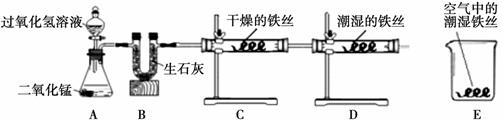
 锈主要与 ▲ 、 ▲ 有关。
锈主要与 ▲ 、 ▲ 有关。