题目内容
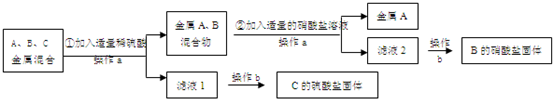
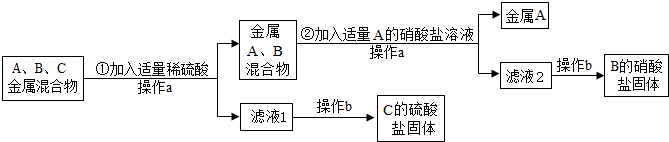
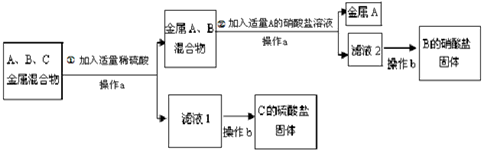
A、B、C分别是Zn、Fe、Ag三种金属中的一种.为了从它们的混合物中分离出金属A和金属C,并获得B的盐,进行如下实验操作.
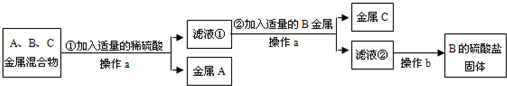
请回答以下问题:
(1)写出①中发生反应的化学方程式______.
(2)金属A是______(填化学式,下同).金属C是______,B的硫酸盐是______(填名称).
解:(1)根据金属的活泼性顺序:锌>铁>氢>银,锌、铁、银三种金属的混合物中加入稀硫酸,锌和铁都能与稀硫酸反应,反应的方程式为:Zn+H2SO4=ZnSO4+H2↑(或Fe+H2SO4=FeSO4+H2↑);
(2)银不能与稀硫酸反应,过滤后得到金属A为银,所得滤液为硫酸锌和硫酸亚铁的溶液;在向滤液中加入B金属能够把C金属从其盐溶液中置换出来,说明B的活动性比C强,故B是锌,C是铁;锌经过和硫酸、硫酸亚铁的置换反应都生成硫酸锌,故B的硫酸盐是硫酸锌.
故答案为:(1)Zn+H2SO4=ZnSO4+H2↑(或Fe+H2SO4=FeSO4+H2↑)
(2)Ag Fe 硫酸锌
分析:据金属的活泼性顺序:锌>铁>氢>银,故向锌、铁、银三种金属的混合物中加入稀硫酸,锌和铁能与稀硫酸反应,而银不与稀硫酸反应;再根据金属B能能与C的盐溶液发生置换反应可以推断出A、B、C三种金属,据此进行分析解答即可.
点评:本题难度不是很大,主要考查学生灵活运用金属活动性顺序进行解题的能力,根据“反应则活泼、不反应则不活泼”确定三种金属是解答本题的关键所在.
(2)银不能与稀硫酸反应,过滤后得到金属A为银,所得滤液为硫酸锌和硫酸亚铁的溶液;在向滤液中加入B金属能够把C金属从其盐溶液中置换出来,说明B的活动性比C强,故B是锌,C是铁;锌经过和硫酸、硫酸亚铁的置换反应都生成硫酸锌,故B的硫酸盐是硫酸锌.
故答案为:(1)Zn+H2SO4=ZnSO4+H2↑(或Fe+H2SO4=FeSO4+H2↑)
(2)Ag Fe 硫酸锌
分析:据金属的活泼性顺序:锌>铁>氢>银,故向锌、铁、银三种金属的混合物中加入稀硫酸,锌和铁能与稀硫酸反应,而银不与稀硫酸反应;再根据金属B能能与C的盐溶液发生置换反应可以推断出A、B、C三种金属,据此进行分析解答即可.
点评:本题难度不是很大,主要考查学生灵活运用金属活动性顺序进行解题的能力,根据“反应则活泼、不反应则不活泼”确定三种金属是解答本题的关键所在.

练习册系列答案
相关题目