题目内容
【题目】探究酸、碱和盐的性质及应用。
(1)NaOH溶液和稀硫酸反应,向滴有酚酞的NaOH溶液中加入稀硫酸,现象为___________,反应的化学方程式为__________。
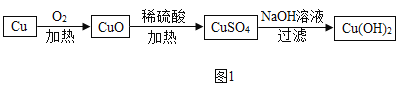
(2)为除去NaCl中混有的少量Na2SO4,某探究小组设计了如图所示方案进行实验。
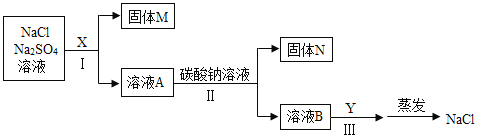
①Ⅰ、Ⅱ两步都有过滤操作,过滤中要用到的玻璃仪器有烧杯、_________和___________。
②甲、乙同学选用的X分别为BaCl2溶液、Ba(OH)2溶液。写出Ⅰ、Ⅱ两步中发生的任意一个反应的化学方程式:___________。甲、乙同学的实验中,可能发生的相同反应的化学方程式为_____________。乙的实验中,步骤Ⅲ涉及的操作和现象是_____________。
③丙同学认为甲的实验比乙的实验更合理,理由是_____________。
【答案】溶液由红色变成无色 2NaOH+H2SO4═Na2SO4+2H2O 漏斗 玻璃棒 BaCl2+Na2SO4═BaSO4↓+2NaCl Na2CO3+2HCl=2NaCl+H2O+CO2↑ 加入足量稀盐酸,产生气泡 甲实验直接生成氯化钠,不会造成药品的浪费
【解析】
(1)滴有酚酞的NaOH溶液是红色溶液,加入稀硫酸时,氢氧化钠和稀硫酸反应生成硫酸钠和水,溶液由碱性变成中性,溶液由红色变成无色,因此现象为溶液由红色变成无色,反应的化学方程式为:2NaOH+H2SO4═Na2SO4+2H2O;
(2)①过滤中要用到的玻璃仪器有烧杯、漏斗和玻璃棒;
②Ⅰ中,硫酸钠和氯化钡反应生成硫酸钡沉淀和氯化钠,和氢氧化钡反应生成硫酸钡沉淀和氢氧化钠,反应的化学方程式为:BaCl2+Na2SO4═BaSO4↓+2NaCl,Ba(OH)2+Na2SO4═BaSO4↓+2NaOH;
Ⅱ中,碳酸钠和氯化钡反应生成碳酸钡沉淀和氯化钠,和氢氧化钡反应生成碳酸钡沉淀和氢氧化钠,反应的化学方程式为:BaCl2+Na2CO3═BaCO3↓+2NaCl,Ba(OH)2+Na2CO3═BaCO3↓+2NaOH;
甲、乙同学的实验中,可能发生的相同反应是利用稀盐酸除去过量的碳酸钠,稀盐酸和碳酸钠反应生成氯化钠、水和二氧化碳,反应的化学方程式为:Na2CO3+2HCl=2NaCl+H2O+CO2↑;
乙的实验中,步骤Ⅲ是加入足量稀盐酸,以除去过量的碳酸钠和生成的氢氧化钠,因此操作和现象是加入足量稀盐酸,产生气泡;
③甲的实验比乙的实验更合理,理由是甲实验直接生成氯化钠,避免了反应生成的氢氧化钠消耗稀盐酸,不会造成药品的浪费。

 阶梯计算系列答案
阶梯计算系列答案【题目】某研究性学习小组以“酸与碱能否发生反应”为课题进行了实验探究。
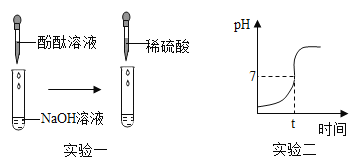
(实验一)
(1)向滴有酚酞试液的NaOH溶液中滴入稀硫酸,观察到溶液颜色由_____,证明硫酸和氢氧化钠发生了反应,该反应的化学方程式为_____。
(2)继续往上述反应后的溶液中逐滴滴入NaOH溶液,不断振荡,如果观察到_____现象,证明了滴加的稀硫酸过量。
(实验二)测量酸和碱反应过程的pH
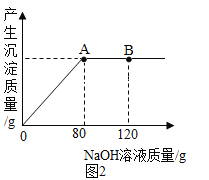
(1)实验过程中用传感器实时获得溶液的pH,要得到如图所得变化曲线,所进行的操作是_____(填字母)。
A 将稀硫酸溶液逐滴滴加到氢氧化钠溶液中
B 将氢氧化钠溶液逐滴滴加到稀硫酸溶液中
(2)根据如图2溶液pH变化,判断酸和碱发生反应的依据是_____。
(实验三)小组同学经过讨论,一致认为除了上述方法外,还可以按照如表实验方法证明硫酸和氢氧化钠发生了反应。
实验步骤 | 实验现象 | 实验结论 |
取少量氢氧化钠溶液于试管中,加入过量的稀硫酸,再加入少量的氧化铜 | 得到蓝色溶液,无_____ | 氢氧化钠和硫酸发生了化 学反应 |
(拓展延伸)同学们对氢氧化钠溶液和稀硫酸反应后溶液中的溶质成分产生了浓厚的兴趣,于是进行了进一步的探究。
(提出问题)氢氧化钠溶液和稀硫酸反应后溶液中的溶质成分
(提出猜想)猜想一:Na2SO4猜想二:Na2SO4和H2SO4你的合理猜想是:_____。
(进行实验)
实验步骤 | 实验现象 | 实验结论 |
取少量反应后的溶液置于试管中_____ | _____ | 猜想二正确 |
(实验反思)在分析化学反应后所得物质成分时,除考虑生成物外还需要考虑反应物是否有剩余。
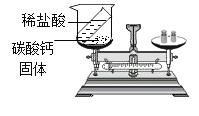
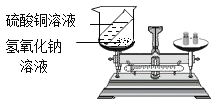
【题目】以下是老师引导学生探究“质量守恒定律”的教学片段,请你参与探究并帮忙填写空格(包括表中的空格)。
(提出问题)化学反应前后各物质的质量总和是否相等?
(猜想与假设)猜想1:不相等;猜想2:相等。
(实验探究)甲、乙两组同学用托盘天平分别称量反应前后物质的质量。
甲组 | 乙组 | |
实验方案(反应后略) |
|
|
实验现象 | 有_____产生,天平指针向_____偏转 | _____,天平指针没有偏转 |
结论 | 猜想1正确 | 猜想2正确 |
(反思评价)究竟哪种猜想正确?通过讨论,同学们发现甲组中有气体逸出,导致指针偏转。得到启示:在探究化学反应前后各物质的质量总和是否相等时,凡是有气体生成或参加的反应一定要在_____中进行。
(改进装置)同学们对甲组左盘中的反应装置进行了如下改进,但是从物理学角度考虑仍有不足,试着指出其不足_____。
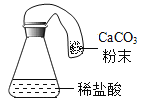
(得出结论)分析发现,反应体系中器材和未参加反应的物质的质量在反应前后保持不变,最终得出结论是:_____的各物质的质量总和等于反应后生成的各物质的质量总和。
(微观解释)从微观角度分析,在化学反应前后一定不变的是_____(选填序号)。
①原子种类 ②分子种类 ③原子数目 ④分子质量 ⑤分子数目 ⑥原子质量