题目内容
(6分)化学兴趣小组的同学用如下图所示装置做中和反应实验,请按要求回答问题。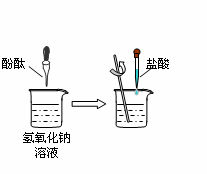
(1)向盛有氢氧化钠溶液的烧杯中滴入酚酞溶液,溶液变为红色,此时溶液的pH 7(填“>”或“<”或“=”),用胶头滴管吸取盐酸逐滴加入烧杯中,并不断用玻璃棒搅拌,当溶液刚好由红色变成 色时,恰好完全中和,停止加入盐酸,该反应的化学方程式为 。
(2)实验(1)中,某同学又多加了几滴盐酸,这时溶液显 性,此时溶液中的溶质为 。
(1)> 无 NaOH+HCl=NaCl+H2O
(2)酸 ; HCl、NaCl、酚酞
解析试题分析:(1)氢氧化钠溶液的pH>7呈碱性,可使酚酞溶液变为红色。用胶头滴管吸取盐酸逐滴加入烧杯中,盐酸会与氢氧化钠反应生成氯化钠和水。反应的化学方程式为NaOH+HCl=NaCl+H2O 当二者恰好完全反应时,溶液的pH=7,呈中性,溶液显无色。
(2)这时再加入盐酸,溶液中盐酸有剩余,显酸性,此时溶液中的溶质为原来存在的酚酞、反应生成的氯化钠和过量的盐酸。
考点:中和和反应

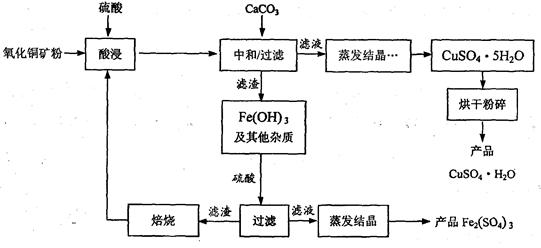
(11分)废铁屑的主要成份是铁,同时还有少量铁锈(Fe2O3),动物饲料硫酸亚铁的生产工艺之一如下图所示:
(1)在反应器中发生反应的化学方程式除Fe2(SO4)3+Fe=3FeSO4外还有: ; 。
(2)滤液M中肯定含有的溶质的化学式是 ;
(3)在实验室中完成操作A的玻璃仪器有玻璃棒、烧杯和 ;
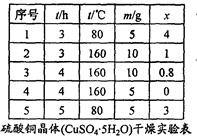
(4)滤液M经过操作B可得硫酸亚铁晶体(FeSO4·7H2O)。已知硫酸亚铁的溶解度和析出晶体的组成如下表:
| 温度/℃ | 0 | 10 | 30 | 40 | 50 | 60 | 64 | 70 | 80 | 90 |
| 溶解度/g | 15.6 | 20.5 | 33.0 | 40.4 | 48.8 | 55.0 | 55.3 | 50.6 | 43.7 | 37.2 |
| 析出晶体 | FeSO4·7H2O | FeSO4·4H2O | FeSO4·H2O | |||||||
根据溶解度表,硫酸亚铁晶体(FeSO4·7H2O)冷却结晶温度最高不超过 ℃;
(5)在化学反应中,若有元素化合价变化的反应定义为氧化还原反应。下列反应类型肯定是氧化还原反应的是 (填字母编号);
A.化合反应 B.置换反应 C.分解反应 D.复分解反应
在氧化还原反应中,若有元素的化合价升高,必有元素的化合价降低,且元素化合价升降总数相等。
将无水硫酸亚铁(FeSO4)隔绝空气加强热,分解产物有三氧化二铁和另两种氧化物,试写出该反应的化学方程式 。