题目内容
如图所示,甲、乙两位同学用如下实验装置测定铜和氧化铜混合物中铜元素的含量,试回答下列有关问题: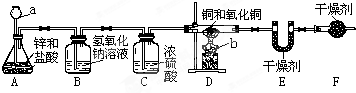
A中可观察到的现象为:

A中可观察到的现象为:
Zn粒逐渐减少,且有气泡产生
Zn粒逐渐减少,且有气泡产生
,反应的化学方程式为:Zn+2HCl═ZnCl2+H2↑
Zn+2HCl═ZnCl2+H2↑
C装置的作用为除去氢气中水蒸气
除去氢气中水蒸气
测定方法:同学甲称量反应前后D装置中玻璃管及其固体物质的质量,同学乙称量反应前后E装置的质量验证同学甲的测定结果.已知D装置中铜和氧化铜混合物的质量为10g,经称量,反应前后E装置的质量分别为100.2g和102.0g,则同学乙测定的原混合物中铜元素的质量分数为84%
84%
(假设各装置中的反应或吸收都是完全的) F装置的作用是吸收空气中的水蒸气,按同学乙的方法如不加F装置,会使实验结果偏低
偏低
(填“偏低”或“偏高”).分析:根据锌和盐酸生成氯化锌和氢气进行解答;根据浓硫酸具有吸水性进行解答;根据E装置增加的质量为水的质量进行解答;根据如不加F装置会使得空气中水蒸气进入使得水的质量增加,那么计算出的氧化铜的质量也随着增加,所以会使实验结果偏小进行解答.
解答:解:(1)锌和盐酸生成氯化锌和氢气,A中可观察到的现象为Zn粒逐渐减少,且有气泡产生;反应的化学方程式为:Zn+2HCl═ZnCl2+H2↑;
(2)浓硫酸具有吸水性,C装置的作用是除去氢气中水蒸气;
(3)E装置增加的质量为水的质量,水的质量=102.0g-100.2g=1.8g
设参加反应的氧化铜的质量为x.
CuO+H2
Cu+H2O
80 18
x 1.8g
=
,解得x=8.0g
氧化铜中铜元素的质量为:8.0g×
×100%=6.4g
原混合物中铜元素的质量分数=
×100%=84%
答:原混合物中铜元素的质量分数为84%.
(4)如不加F装置会使得空气中水蒸气进入使得水的质量增加,那么计算出的氧化铜的质量也随着增加,所以会使实验结果偏小.(如果题目设计原理是利用D装置质量变化前后求算,则是否用后面装置都不影响,所以不同的设计原理对操作和实验的仪器要求也不同,建议同学们平时要学会从不同的角度去考虑实验目的设计问题)
故答案为:(1)Zn粒逐渐减少,且有气泡产生;Zn+2HCl═ZnCl2+H2↑;(2)除去氢气中水蒸气;(4)84%;(6)偏低;
(2)浓硫酸具有吸水性,C装置的作用是除去氢气中水蒸气;
(3)E装置增加的质量为水的质量,水的质量=102.0g-100.2g=1.8g
设参加反应的氧化铜的质量为x.
CuO+H2
| ||
80 18
x 1.8g
| 80 |
| x |
| 18 |
| 1.8g |
氧化铜中铜元素的质量为:8.0g×
| 64 |
| 64+16 |
原混合物中铜元素的质量分数=
| 10.0g-8.0g+6.4g |
| 10.0g |
答:原混合物中铜元素的质量分数为84%.
(4)如不加F装置会使得空气中水蒸气进入使得水的质量增加,那么计算出的氧化铜的质量也随着增加,所以会使实验结果偏小.(如果题目设计原理是利用D装置质量变化前后求算,则是否用后面装置都不影响,所以不同的设计原理对操作和实验的仪器要求也不同,建议同学们平时要学会从不同的角度去考虑实验目的设计问题)
故答案为:(1)Zn粒逐渐减少,且有气泡产生;Zn+2HCl═ZnCl2+H2↑;(2)除去氢气中水蒸气;(4)84%;(6)偏低;
点评:该题是一道综合实验题,实验设计严密,考查的知识点较多,解题的关键是明确实验目的和原理,分析综合装置各部分的作用.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
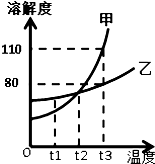 如图所示是甲、乙两固体物质的溶解度曲线,请回答下列问题
如图所示是甲、乙两固体物质的溶解度曲线,请回答下列问题