题目内容
某同学利用以下药品:长、宽和厚度均相同的锌片、铁片与铜片、稀硫酸、硫酸亚铁溶液、硫酸铜溶液、硫酸锌溶液、锌粉,进行锌、铁、铜的金属活动性顺序探究等实验.
(1)实验前,用砂纸打磨金属片的目的是______;
(2)根据实验目的,该同学设计了实验I、Ⅱ两种合理的方案,如图1所示: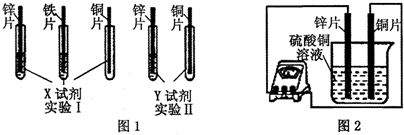
若X、Y是两种不同的试剂,则X、Y中溶质的化学式依次为______、______;
(3)实验后,该同学将硫酸亚铁溶液和硫酸铜溶液混合在一起,发现溶液呈现青色.他又用混合液分别进行以下实验:
A.向混合液中加入过量锌粉,搅拌,溶液颜色的变化为:青色变浅至______色,最终变为无色;
B.向混合液中插入锌片,待其浸没部分表面完全变色后,溶液仍为青色,取下锌片表面附着的粉末,经检验其组成为铁和铜.和老师一起分析粉末中存在铁的原因:
①反应生成了铁,写出该反应的化学方程式:______;
②铜和锌构成原电池,电子转移过程中亚铁离子得到电子变成铁单质;
(4)如图2所示,该同学用导线将锌片和铜片连接起来,接入电流表,然后把它们一起插入硫酸铜溶液中,该实验的现象为:
①电流表指针是否发生偏转______(选填“是”或“否”);
②铜片表面变粗.
(1)实验前,用砂纸打磨金属片的目的是______;
(2)根据实验目的,该同学设计了实验I、Ⅱ两种合理的方案,如图1所示:

若X、Y是两种不同的试剂,则X、Y中溶质的化学式依次为______、______;
(3)实验后,该同学将硫酸亚铁溶液和硫酸铜溶液混合在一起,发现溶液呈现青色.他又用混合液分别进行以下实验:
A.向混合液中加入过量锌粉,搅拌,溶液颜色的变化为:青色变浅至______色,最终变为无色;
B.向混合液中插入锌片,待其浸没部分表面完全变色后,溶液仍为青色,取下锌片表面附着的粉末,经检验其组成为铁和铜.和老师一起分析粉末中存在铁的原因:
①反应生成了铁,写出该反应的化学方程式:______;
②铜和锌构成原电池,电子转移过程中亚铁离子得到电子变成铁单质;
(4)如图2所示,该同学用导线将锌片和铜片连接起来,接入电流表,然后把它们一起插入硫酸铜溶液中,该实验的现象为:
①电流表指针是否发生偏转______(选填“是”或“否”);
②铜片表面变粗.
(1)金属在空气中其表面会生成一层氧化膜,氧化膜会阻止金属与药品接触,要先除去氧化膜,所以实验前,用砂纸打磨金属片的目的是除去金属表面的氧化膜:
(2)实验1:给定三种金属,因此可以和酸混合:将三种金属分别与硫酸混合后,铜与稀硫酸不反应,锌、铁均能与稀硫酸反应生成气体,且锌的反应比铁剧烈,可以得出锌>铁>铜;
实验2:给定两种金属,可以和中间金属的盐溶液混合,由于锌能与硫酸亚铁反应,说明锌在铁的前面,铜不与硫酸亚铁反应,说明铜在铁的后面,所以可以选用的另一种药品是硫酸亚铁;
(3)A、硫酸亚铁溶液是浅绿色,硫酸铜溶液是蓝色,两种溶液混合后呈现青色,加入过量的锌粉后,先和硫酸铜溶液发生置换反应,青色变浅,硫酸铜完全反应后,溶液变为浅绿色,锌再与硫酸亚铁发生置换反应,生成硫酸锌,溶液呈现无色;
B、锌和硫酸亚铁反应生成硫酸锌和铁,化学方程式为:Zn+FeSO4═ZnSO4+Fe;
(4)原电池中锌比铜活泼,所以锌失去电子,电子从锌片流向铜片,而电流从铜片流向锌片,所以电流表指针发生偏转.
故答案为:(1)除去金属表面的氧化膜;
(2)H2SO4、FeSO4;
(3)浅绿,Zn+FeSO4═ZnSO4+Fe;
(4)是.
(2)实验1:给定三种金属,因此可以和酸混合:将三种金属分别与硫酸混合后,铜与稀硫酸不反应,锌、铁均能与稀硫酸反应生成气体,且锌的反应比铁剧烈,可以得出锌>铁>铜;
实验2:给定两种金属,可以和中间金属的盐溶液混合,由于锌能与硫酸亚铁反应,说明锌在铁的前面,铜不与硫酸亚铁反应,说明铜在铁的后面,所以可以选用的另一种药品是硫酸亚铁;
(3)A、硫酸亚铁溶液是浅绿色,硫酸铜溶液是蓝色,两种溶液混合后呈现青色,加入过量的锌粉后,先和硫酸铜溶液发生置换反应,青色变浅,硫酸铜完全反应后,溶液变为浅绿色,锌再与硫酸亚铁发生置换反应,生成硫酸锌,溶液呈现无色;
B、锌和硫酸亚铁反应生成硫酸锌和铁,化学方程式为:Zn+FeSO4═ZnSO4+Fe;
(4)原电池中锌比铜活泼,所以锌失去电子,电子从锌片流向铜片,而电流从铜片流向锌片,所以电流表指针发生偏转.
故答案为:(1)除去金属表面的氧化膜;
(2)H2SO4、FeSO4;
(3)浅绿,Zn+FeSO4═ZnSO4+Fe;
(4)是.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目