题目内容
11.5g氢氧化钙、碳酸钙和氧化钙的固体混合物与109.5g10%的盐酸溶液恰好完全反应,反应后溶液重118.8g,再加入47.7g水后,则所得溶液中溶质的质量分数是( )
【答案】分析:由于氢氧化钙、碳酸钙、氧化钙与盐酸恰好完全反应都生成氯化钙,因此由盐酸中溶质的质量可以计算出生成氯化钙的质量,再根据质量分数的计算公式可得本题答案.
解答:解:设生成氯化钙的质量为x.
由Ca(OH)2+2HCl=CaCl2+2H2O、
CaCO3+2HCl=CaCl2+H2O+CO2↑、
CaO+2HCl=CaCl2+H2O看出:
2HCl→CaCl2
73 111
109.5g×10% x
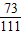 =
=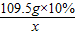 ,x=16.65g
,x=16.65g
所得溶液中溶质的质量分数为
 ×100%=10%
×100%=10%
故选A.
点评:本题主要考查有关化学方程式的计算和溶质质量分数的计算,难度较大.
解答:解:设生成氯化钙的质量为x.
由Ca(OH)2+2HCl=CaCl2+2H2O、
CaCO3+2HCl=CaCl2+H2O+CO2↑、
CaO+2HCl=CaCl2+H2O看出:
2HCl→CaCl2
73 111
109.5g×10% x
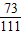 =
=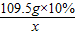 ,x=16.65g
,x=16.65g所得溶液中溶质的质量分数为
 ×100%=10%
×100%=10%故选A.
点评:本题主要考查有关化学方程式的计算和溶质质量分数的计算,难度较大.

练习册系列答案
相关题目
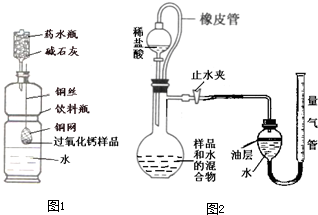 (2011?仪征市一模)长途运输鱼苗时,人们常在水中加入少量过氧化钙(CaO2)固体,为鱼提供氧气,过氧化钙与水反应除生成氧气外,还生成什么物质?课外兴趣小组决定对这一过程中进行探究:
(2011?仪征市一模)长途运输鱼苗时,人们常在水中加入少量过氧化钙(CaO2)固体,为鱼提供氧气,过氧化钙与水反应除生成氧气外,还生成什么物质?课外兴趣小组决定对这一过程中进行探究: