题目内容
【题目】元素周期表是学习和研究化学的重要工具,下表是元素周期表的部分内容,请认真分析并回答下列问题:
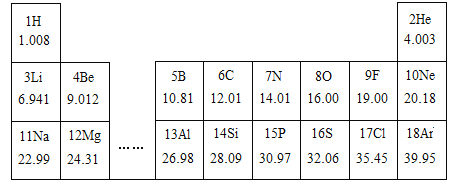
(1)请从上表中查出铝元素的相对原子质量为______;
(2)不同种元素最本质的区别是______![]() 填序号
填序号![]() ;
;
A相对原子质量不同 B质子数不同 C中子数不同
(3)金属Na、Mg化学性质不同的原因是______;
(4)元素周期表中每一个横行叫做一个周期,通过分析,同一周期元素之间的排列有一定的规律,请写出其中一条:______。
【答案】26.98 B 最外层电子数不相等 电子层数相等(合理即可)
【解析】
元素周期表中,方格中左上角是原子序数,右上角是元素符号,中间是元素名称,下面是相对原子质量;
一般情况下,最外层电子数小于4的,反应中容易失去电子,大于4的反应中容易得到电子,等于4的,既不容易得到电子,也不容易失去电子,因此最外层电子数相等的元素化学性质相似,最外层电子数是8的是一种稳定结构,第一层也是最外层时,达到2个电子也是一种稳定结构。
(1)铝元素的相对原子质量为26.98。故填:26.98。
(2)元素是具有相同质子数的一类原子的总称;不同种元素最本质的区别是质子数不同。故填:B。
(3)元素的化学性质与原子最外层电子数关系密切。金属Na、Mg化学性质不同的原因是最外层电子数不相等。
故填:最外层电子数不相等。
(4)同一周期元素之间的排列有一定的规律,例如电子层数相等,最外层电子数依次递增等。
故填:电子层数相等(合理即可)。

【题目】除去下列物质中混有的杂质,所用试剂和操作方法不正确的是![]()
物质 | 所含杂质 | 除杂质选用的试剂或方法 | |
A | NaCl溶液 | NaOH | 滴加适量的稀盐酸 |
B | Cu | Fe | 加入足量的稀盐酸并过滤 |
C |
| CO | 在氧气中点燃 |
D |
|
| 加入足量的水溶解并过滤、洗涤、干燥 |
A. A B. B C. C D. D
【题目】某兴趣小组对酸碱中和反应进行了如下探究。请回答相关问题。
I.探究酸和碱能否发生反应
方案l:甲同学向盛有少量NaOH溶液的试管中滴几滴无色酚酞试液,振荡,继续加入稀硫酸,观察到溶液由______色变成无色。甲同学得出结论:酸和碱能发生反应。请写出稀硫酸和氢氧化钠溶液反应的化学方程式________。
方案2:乙同学取少量NaOH溶液,测得溶液pH为10,向该溶液中加入一定量稀硫酸后,测得溶液pH为9,乙同学发现溶液pH减小了,得出结论:酸和碱能发生反应。
交流讨论:大家同意甲同学的结论,对乙同学的实验过程提出质疑,溶液pH减小的原因还可能是稀硫酸中的水稀释了NaOH溶液;大家认为,乙同学向NaOH溶液中加入稀硫酸后,测得溶液的pH必须________(填“小于”或“小于或等于”)7,才能证明酸和碱能发生反应。
II.探究酸和碱反应后溶液中溶质的成分
丙同学对探究I中甲同学实验后的无色溶液展开探究。
(提出问题)试管中无色溶液的溶质除了酚酞还有什么?
(提出猜想)(l)Na2SO4;(2)______。
(设计实验)
实验操作 | 实验现象 | 实验结论 | |
方案I | 向试管中加入少量锌粒,然后加入甲同学实验后的无色溶液 | 锌粒逐渐减少,有_______产生 | 猜想(2)成立 |
方案II | 向试管中加入少量甲同学实验后的无色溶液,然后慢慢滴加NaOH溶液,并不断振荡试管 | 开始无明显现象,过一会发现______。 |
(实验反思)为了验证猜想(2)成立,你认为还可以选择的药品是____(填字母序号)。
A BaCl2溶液 B Cu C Fe2O3 D Cu(OH)2