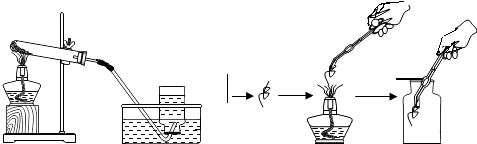
题目内容
【题目】甲、乙两组同学分别设计了如下实验,图中试剂混合前后物质的总质量分别表示为M(前)、M(后). 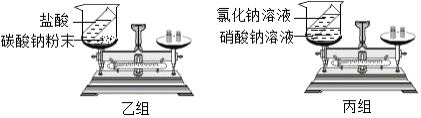
请根据图示回答:
(1)甲组实验中,M(前)>M(后),原因是;若所用试剂不变,改进的方法是;
(2)乙组实验中,M(前)=M(后),丙组同学认为该实验不能验证质量守恒定律,原因是 .
(3)丁组同学研究了物质W的组成.一定条件下,W在密闭容器内发生反应前后各物质的质量如下图所示: 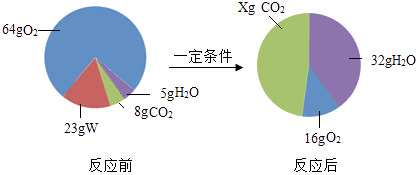
其中,x=g,W的化学式是 . (按碳、氢、氧元素顺序书写)
【答案】
(1)二氧化碳气体逸出;将烧杯改成密闭容器
(2)质量守恒定律研究的是化学反应,而丙组中的物质不能发生化学反应
(3)52;C2H6O
【解析】解:(1)由于乙装置是敞口的装置,产生的二氧化碳从烧杯中逸散出去,总质量减少;改进此装置的方法是:将烧杯改成密闭容器;(2)质量守恒定适用于化学反应,因为丙组的两种药品未参加化学反应,所以不能验证质量守恒定律;(3)由于四种物质中W和氧气质量减小,所以是反应物,且反应物的总质量是23g+(64g﹣16g)=71g,而水的质量增加,且增加值是32g﹣5g=27g,依据质量守恒定律参加化学反应的各物质质量总和等于反应后生成的各物质质量总和,所以二氧化碳必是生成物且生成的质量是71g﹣27g=44g;此反应的表达式可表示为W+O2→CO2+H2O.由以上分析知X的值等于44g+8g=52g; 先根据反应前后元素的种类不变,确定:w中一定含有碳、氢两种元素,可能含有氧元素.再根据反应前后元素的质量相等,来确定氧元素是否含有.44g二氧化碳中碳元素的质量=44g× ![]() =12g,32g﹣5g=27g水中氢元素的质量=27g×
=12g,32g﹣5g=27g水中氢元素的质量=27g× ![]() =3g.二氧化碳中氧元素的质量为:44g﹣12g=32g,水中氧元素的质量为:27g﹣3g=24g,故反应前应有氧元素的质量为:32g+24g=56g,而参加反应的氧气中有氧元素64﹣12=48g,故w中应含有56﹣48=8g的氧元素,故w中碳、氢、氧三种元素的质量比为:12:3:8,碳、氢、氧三种元素的原子个数比为:
=3g.二氧化碳中氧元素的质量为:44g﹣12g=32g,水中氧元素的质量为:27g﹣3g=24g,故反应前应有氧元素的质量为:32g+24g=56g,而参加反应的氧气中有氧元素64﹣12=48g,故w中应含有56﹣48=8g的氧元素,故w中碳、氢、氧三种元素的质量比为:12:3:8,碳、氢、氧三种元素的原子个数比为: ![]() :
: ![]() :
: ![]() =2:6:1,故w的化学式为:C2H6O;
=2:6:1,故w的化学式为:C2H6O;
所以答案是:(1)二氧化碳气体逸出;将烧杯改成密闭容器;(2)质量守恒定律研究的是化学反应,而丙组中的物质不能发生化学反应;(3)52;C2H6O.
【考点精析】根据题目的已知条件,利用质量守恒定律及其应用的相关知识可以得到问题的答案,需要掌握①质量守恒定律只适用于化学变化,不适用于物理变化;②不参加反应的物质质量及不是生成物的物质质量不能计入“总和”中;③要考虑空气中的物质是否参加反应或物质(如气体)有无遗漏.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案