题目内容
现有一瓶标签如图所示的浓盐酸,请根据标签上的数据回答问题:| 盐酸 体积:500mL 化学式:HCl 相对分子质量:36.5 密度:1.2g/cm3 质量分数:37%(1)用该浓盐酸100ml能配制质量分数为20%的盐酸 (2)利用刚配制的稀盐酸来测定某碳酸钠样品的纯度(样品不含氢元素):取50g该样品,向其中滴入刚配好的稀盐酸至不再产生气泡为止,共用去盐酸146g. ①发生反应的化学方程式 ②利用已知条件求解参加反应的固体物质质量(x)的比例式 ③该样品的成分是 ④该样品的纯度是 ⑤若向反应后溶液中加入46.8g水后,此时所得溶液中溶质的质量分数为 分析:(1)利用标签中的说明数据,根据稀释前后溶质质量不变,计算稀释后溶液质量; (2)运用题目意图写出反应的化学方程式;根据化学方程式,利用146g20%的稀盐酸,列出计算碳酸钠质量的比例式;利用碳酸钠质量除以样品质量求出样品纯度; 解答:解:(1)用100mL盐酸可以配制溶质质量分数为20%的盐酸溶液的质量=100mL×1.2g/cm3×37%÷20%=222g 故答案为:222g (2)146g20%的盐酸溶液中HCl质量=146g×20%=29.2设样品中碳酸钠质量为x,反应后生成氯化钠的质量为y,生成二氧化碳的质量为Z. Na2CO3+2HCl=2NaCl+H2O+CO2↑ 106 73 117 44 x 29.2g y z
解得:x=42.4g y=46.8g z=17.6g 则样品中碳酸钠的纯度=
反应后所得溶液的溶质的质量分数为=
答:样品中碳酸钠的质量分数为84.8%. 点评:根据稀释前后溶质质量不变,计算稀释后溶液质量;求出146g20%的盐酸溶液中HCl质量为已知量带入化学方程式求出样品中碳酸钠的质量,这是进一步解决问题的关键. 
练习册系列答案
相关题目
现有一瓶标签如图所示的浓盐酸,请根据标签上的数据回答问题:
(2)利用刚配制的稀盐酸来测定某碳酸盐样品的纯度(不含氢元素):取一定量该碳酸盐(R2C03)样品,向其中滴入刚配好的稀盐酸至不再产生气泡为止,共用去盐酸73g(杂质不与盐酸反应也不溶于水),然后过滤,得滤渣2.8g,将所得滤液蒸干,得到固体纯净物23.4g. ①发生反应的化学方程式. ③利用已知条件求解参加反应的固体物质质量(x)的比例式 ④该样品的纯度是 ⑤若向反应后溶液中加入31.6g水后,此时所得溶液中溶质的质量分数为 |
 现有一瓶标签如图所示的浓盐酸,请根据标签上的数据回答问题:
现有一瓶标签如图所示的浓盐酸,请根据标签上的数据回答问题: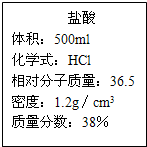 现有一瓶标签如图所示的浓盐酸,请根据标签完成下列问题:
现有一瓶标签如图所示的浓盐酸,请根据标签完成下列问题: (1)氮肥硝酸铵化学式为NH4NO3.其中N元素的化合价为
(1)氮肥硝酸铵化学式为NH4NO3.其中N元素的化合价为