题目内容
现有A、B两种金属组成的混合物30克,与足量的稀盐酸反应放出1克氢气.该混合物的组成可能是锌、镁、铁、铝中的(写出所有可能的组成) .
【答案】分析:假设与酸反应的金属的相对原子质量为x,利用金属与盐酸反应的化学方程式和生成氢气的质量,列出比例式,就可计算出x的值,然后根据组合的原则,即可正确解答.
解答:解:设锌、镁、铁、铝在与酸反应时都看作+2价金属,则各金属的化学式的式量为:锌:65;镁:24;铁:56;铝:18.产生氢气1克,
设与酸反应的金属的相对原子质量为x,根据反应:
M+2HCl═MCl2+H2↑;
x 2
30g 1g
∴ ,
,
解之得:x= =60;
=60;
所以,组成该合金的金属的相对原子质量应该满足一个大于60,一个小于60,故组合为:镁与锌;锌与铁;锌与铝.
点评:本题主要考查学生运用化学方程式和组合的原则解答问题的能力.解题的关键是利用化学方程式计算出组成该合金的金属的相对原子质量应该满足的数值.
解答:解:设锌、镁、铁、铝在与酸反应时都看作+2价金属,则各金属的化学式的式量为:锌:65;镁:24;铁:56;铝:18.产生氢气1克,
设与酸反应的金属的相对原子质量为x,根据反应:
M+2HCl═MCl2+H2↑;
x 2
30g 1g
∴
 ,
,解之得:x=
 =60;
=60;所以,组成该合金的金属的相对原子质量应该满足一个大于60,一个小于60,故组合为:镁与锌;锌与铁;锌与铝.
点评:本题主要考查学生运用化学方程式和组合的原则解答问题的能力.解题的关键是利用化学方程式计算出组成该合金的金属的相对原子质量应该满足的数值.

练习册系列答案
相关题目
 探究活动一:在室温条件下进行如图所示实验.已知:试管内的镁条和铁片表面均被打磨洁净,且形状、大小均相同;同时加入两支试管中的稀盐酸的质量和质量分数均相等.
探究活动一:在室温条件下进行如图所示实验.已知:试管内的镁条和铁片表面均被打磨洁净,且形状、大小均相同;同时加入两支试管中的稀盐酸的质量和质量分数均相等.


 搅拌
搅拌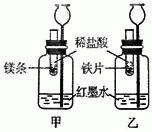
 过滤、洗涤、干燥、称量所得固体质量
过滤、洗涤、干燥、称量所得固体质量 过滤、洗涤、干燥、称量所得固体质量
过滤、洗涤、干燥、称量所得固体质量