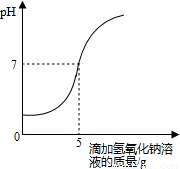
题目内容
硫酸厂排放的污水中通常含有硫酸杂质.为测定污水中硫酸的溶质质量分数某学习小组做如下实验:取10g该污水,向污水中逐滴加入溶质质量分数为8%的氢氧化钠溶液,所滴加氢氧化钠溶液的质量与溶液pH变化关系如图所示.(污水中其它物质不与氢氧化钠反应.(1)该污水中硫酸的溶质质量分数是多少.(计算过程保留2位小数)
(2)小明设计了一个实验方案,即用10g污水与10%的BaCl2溶液反应来分析污水中硫酸的溶质质量分数.请你画出加入溶液与生成沉淀质量变化关系的曲线(见答题卡).

【答案】分析:(1)根据所滴加氢氧化钠溶液的质量与溶液pH变化关系图所示,当加入5g溶质质量分数为8%的氢氧化钠溶液时,溶液的酸碱度等于7,说明此时恰好完全反应;根据反应的化学方程式,由此时所消耗氢氧化钠的质量计算10g该污水中硫酸的质量,从而求得该污水中硫酸的溶质质量分数;
(2)绘制加入溶液与生成沉淀质量变化关系的曲线,需要计算出恰好完全反应时氯化钡溶液的质量及产生沉淀的质量,以确定产生沉淀的最大值即曲线的折点.
解答:解:(1)设污水中硫酸的质量为x
H2SO4+2NaOH=Na2SO4+2H2O
98 80
x 5g×8%
 =
=
x=0.49g
污水中硫酸溶质质量分数= ×100%=4.9%
×100%=4.9%
答:该污水中硫酸的溶质质量分数是4.9%;
(2)设与10g污水反应的10%的BaCl2溶液质量为y,生成沉淀的质量为z
H2SO4+BaCl2═BaSO4↓+2HCl
98 208 233
0.49g y×10% z
 =
= =
=
解得y=10.4g,z=1.17g
故答案为:

点评:绘制加入溶液与生成沉淀质量变化关系的曲线,主要解决恰好完全反应时需要氯化钡溶液的质量及生成沉淀的质量,即曲线的折点.
(2)绘制加入溶液与生成沉淀质量变化关系的曲线,需要计算出恰好完全反应时氯化钡溶液的质量及产生沉淀的质量,以确定产生沉淀的最大值即曲线的折点.
解答:解:(1)设污水中硫酸的质量为x
H2SO4+2NaOH=Na2SO4+2H2O
98 80
x 5g×8%
 =
=
x=0.49g
污水中硫酸溶质质量分数=
 ×100%=4.9%
×100%=4.9%答:该污水中硫酸的溶质质量分数是4.9%;
(2)设与10g污水反应的10%的BaCl2溶液质量为y,生成沉淀的质量为z
H2SO4+BaCl2═BaSO4↓+2HCl
98 208 233
0.49g y×10% z
 =
= =
=
解得y=10.4g,z=1.17g
故答案为:

点评:绘制加入溶液与生成沉淀质量变化关系的曲线,主要解决恰好完全反应时需要氯化钡溶液的质量及生成沉淀的质量,即曲线的折点.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
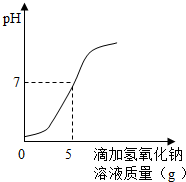 硫酸厂排放的污水中通常含有硫酸杂质.为测定污水中硫酸的溶质质量分数某学习小组做如下实验:取10g该污水,向污水中逐滴加入溶质质量分数为8%的氢氧化钠溶液,所滴加氢氧化钠溶液的质量与溶液pH变化关系如图所示.(污水中其它物质不与氢氧化钠反应.
硫酸厂排放的污水中通常含有硫酸杂质.为测定污水中硫酸的溶质质量分数某学习小组做如下实验:取10g该污水,向污水中逐滴加入溶质质量分数为8%的氢氧化钠溶液,所滴加氢氧化钠溶液的质量与溶液pH变化关系如图所示.(污水中其它物质不与氢氧化钠反应.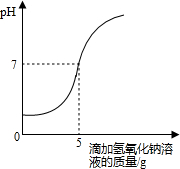 硫酸厂排放的污水中通常含有硫酸杂质.为测定污水中硫酸的溶质质量分数做如下实验:取10g该污水,向污水中逐滴加入溶质质量分数为4%的氢氧化钠溶液,所滴加氢氧化钠溶液的质量与溶液pH变化关系如图所示.请根据实验计算,该污水中硫酸的溶质质量分数是多少?
硫酸厂排放的污水中通常含有硫酸杂质.为测定污水中硫酸的溶质质量分数做如下实验:取10g该污水,向污水中逐滴加入溶质质量分数为4%的氢氧化钠溶液,所滴加氢氧化钠溶液的质量与溶液pH变化关系如图所示.请根据实验计算,该污水中硫酸的溶质质量分数是多少?