题目内容
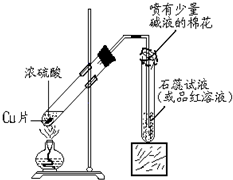 某化学兴趣小组的同学在探究金属铜的化学性质时,发现铜与稀硫酸在常温或短时间加热的条件下均不反应.那么铜与浓硫酸能否发生反应?他们设计了如图所示装置进行探究.
某化学兴趣小组的同学在探究金属铜的化学性质时,发现铜与稀硫酸在常温或短时间加热的条件下均不反应.那么铜与浓硫酸能否发生反应?他们设计了如图所示装置进行探究.猜想与假设:
①在常温下能反应;
②常温下不能反应,但在加热条件下能反应;
③在加热条件下不能反应.
实验与事实:操作①将一小块铜片放入试管中,加入足量浓硫酸,无明显现象;操作②加热该试管,铜片上有气泡产生,经检验产生有毒的刺激性气味气体;操作③立即停止加热,将试管中的残液慢慢倒入水中,溶液呈蓝色.
?结论与解释:
(1)由以上探究可知:猜想
②
②
;(填编号)是正确的;(2)经检验产生的气体是SO2,铜跟浓硫酸在加热条件下反应的产物只是SO2和CuSO4.
反思与评价:
(3)操作③中,从安全角度考虑(填能或不能)
不能
不能
将水倒入剩余液体中.(4)在结论与解释②中对产物是SO2和CuSO4的判断是否正确
不正确
不正确
,其理由是反应物中有氢元素,但二氧化硫和硫酸铜中都不含氢元素.
反应物中有氢元素,但二氧化硫和硫酸铜中都不含氢元素.
.[拓展与运用]:根据以上探究和已掌握的知识,该兴趣小组的同学设计了两个制取硫酸铜的实验方案:
①Cu
| H2SO4(浓) |
| △ |
| O2 |
| △ |
| H2SO4(稀) |
(5)请你对以上两个方案进行评价,较好的方案是
②
②
(填编号)其理由是比较安全;硫酸的利用率比甲高;没有污染空气的SO2生成
比较安全;硫酸的利用率比甲高;没有污染空气的SO2生成
.分析:结论与解释:从实验的过程可以证明铜和浓硫酸能反应,生成物中有二氧化硫和硫酸铜,其中的二氧化硫是有毒气体,不能直接排放到空气中,应该用碱液吸收.
反思与评价:浓硫酸溶于水要放出大量的热,所以浓硫酸不能倒入水中,浓硫酸中含有氢元素,生成物中也要有氢元素;
拓展与运用:考虑制取硫酸铜的方案的优缺点时,要从原料的利用率,环保,安全等方面考虑.
反思与评价:浓硫酸溶于水要放出大量的热,所以浓硫酸不能倒入水中,浓硫酸中含有氢元素,生成物中也要有氢元素;
拓展与运用:考虑制取硫酸铜的方案的优缺点时,要从原料的利用率,环保,安全等方面考虑.
解答:解:[结论与解释](1)根据实验操作和现象,可以证明铜和浓硫酸在加热的时候能反应,生成物中有二氧化硫和硫酸铜,所以猜想②正确;
[反思与评价]:(3)浓硫酸溶于水会放出大量的热,造成液滴飞溅,所以不能把含浓硫酸的物质倒入水中.
(4)因为反应物中有氢,硫、氧、铜四种元素,根据反应前后元素的种类不变的原则,生成物中应该有氢元素,所以生成物质中除二氧化硫和硫酸铜外还有含有氢元素的物质存在.
[拓展与运用]比较这两个方案,从经济,环保,安全的角度考虑,浓硫酸使用时要注意安全,二氧化硫有毒等,通过综合考虑,利用废铜屑和浓硫酸在加热的条件下反应制取CuSO4,浓硫酸具有极强的腐蚀性,使用不安全,有一部分硫元素转化成二氧化硫,污染空气,且造成原料的浪费,CuO与稀硫酸反应直接生成硫酸铜和水,所以方案②比①要好的多.
故答案为:(1)②;(3)不能;(4)不正确.反应物中有氢元素,但二氧化硫和硫酸铜中都不含氢元素.
(5)②;②的方案比较安全;硫酸的利用率比①高;没有污染空气的SO2生成.
[反思与评价]:(3)浓硫酸溶于水会放出大量的热,造成液滴飞溅,所以不能把含浓硫酸的物质倒入水中.
(4)因为反应物中有氢,硫、氧、铜四种元素,根据反应前后元素的种类不变的原则,生成物中应该有氢元素,所以生成物质中除二氧化硫和硫酸铜外还有含有氢元素的物质存在.
[拓展与运用]比较这两个方案,从经济,环保,安全的角度考虑,浓硫酸使用时要注意安全,二氧化硫有毒等,通过综合考虑,利用废铜屑和浓硫酸在加热的条件下反应制取CuSO4,浓硫酸具有极强的腐蚀性,使用不安全,有一部分硫元素转化成二氧化硫,污染空气,且造成原料的浪费,CuO与稀硫酸反应直接生成硫酸铜和水,所以方案②比①要好的多.
故答案为:(1)②;(3)不能;(4)不正确.反应物中有氢元素,但二氧化硫和硫酸铜中都不含氢元素.
(5)②;②的方案比较安全;硫酸的利用率比①高;没有污染空气的SO2生成.
点评:排在氢后的金属不与酸发生置换反应,但是可以和强氧化性的酸反应,完成本题,可以从题干给出的内容,提取有用的信息,分析归纳从而得出合理的答案.

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
 12、碳酸氢钠(NaHCO3)俗称小苏打,常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的性质进行探究.
12、碳酸氢钠(NaHCO3)俗称小苏打,常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的性质进行探究.


 (2012?烟台)某化学兴趣小组的同学用如图所示装置进行实验(装置气密性良好),先关闭止水夹,将足量的氢氧化钠溶液滴入烧瓶中,充分吸收掉二氧化碳后,再打开止水夹.
(2012?烟台)某化学兴趣小组的同学用如图所示装置进行实验(装置气密性良好),先关闭止水夹,将足量的氢氧化钠溶液滴入烧瓶中,充分吸收掉二氧化碳后,再打开止水夹. 某化学兴趣小组的同学在实验室配制质量分数为8%的氢氧化钠溶液,并用其测定某稀盐酸中溶质的质量分数.
某化学兴趣小组的同学在实验室配制质量分数为8%的氢氧化钠溶液,并用其测定某稀盐酸中溶质的质量分数.